题目内容
【题目】我国电池的年市场消费量约为80亿只,其中![]() 是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体
是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体![]() 和纯
和纯![]() 的工艺如下图所示:
的工艺如下图所示:
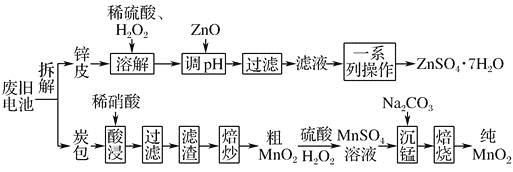
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为![]() 、
、![]() 、
、![]() 、碳粉等,还含有少量的Cu、Ag、Fe等。
、碳粉等,还含有少量的Cu、Ag、Fe等。
②![]() ;
;![]() ;
;![]() 。
。
(1)除去炭包中碳粉的操作为________。
A.酸浸 ![]() 过滤
过滤 ![]() 焙炒
焙炒 ![]() 焙烧
焙烧
(2)粗![]() 转化为
转化为![]() 时,主要反应的离子方程式为____________________________。
时,主要反应的离子方程式为____________________________。
(3)焙烧时发生反应的化学方程式为__________________________________________。
(4)制备硫酸锌晶体流程中,在溶解时加![]() 的作用是____________________________,用ZnO调节溶液pH的目的是_____________________________。滤液制备硫酸锌晶体
的作用是____________________________,用ZnO调节溶液pH的目的是_____________________________。滤液制备硫酸锌晶体![]() 的一系列操作为:____________、____________、________、洗涤、干燥。
的一系列操作为:____________、____________、________、洗涤、干燥。
(5)“草酸钠![]() 高锰酸钾返滴法”可测定
高锰酸钾返滴法”可测定![]() 的纯度,取
的纯度,取![]() 样品于锥形瓶中,加入适量稀硫酸,再加入足量的
样品于锥形瓶中,加入适量稀硫酸,再加入足量的![]() 溶液,最后用
溶液,最后用![]() 溶液滴定剩余的
溶液滴定剩余的![]() 。其中
。其中![]() 与
与![]() 溶液反应的离子方程式为__________________________________________。
溶液反应的离子方程式为__________________________________________。
【答案】![]()
![]()
![]()
![]()
![]() 将溶液中
将溶液中![]() 氧化成
氧化成![]() 除去溶液中的
除去溶液中的![]() 杂质 蒸发浓缩 冷却结晶 过滤
杂质 蒸发浓缩 冷却结晶 过滤 ![]()
【解析】
用硫酸酸化的H2O2溶液溶解含铁的锌皮,所得溶液中含有Zn2+、Fe3+,然后加入ZnO调节溶液pH,使溶液中的Fe3+完全转化为Fe(OH)3沉淀,过滤后将滤液蒸发浓缩、冷却结晶并过滤得到ZnSO47H2O;用稀硝酸溶解炭包并过滤,滤渣为碳和二氧化锰的混合物,在空气中焙烧,碳氧化为二氧化碳,将剩余的粗MnO2用用硫酸酸化的H2O2溶液溶解,得到MnSO4溶液,再滴加Na2CO3溶液,生成MnCO3沉淀,过滤并将滤渣继续在空气中焙烧即得到纯MnO2。
(1)炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,其中碳粉能在空气中燃烧生成二氧化碳气体;
(2)粗MnO2用用硫酸酸化的H2O2溶液溶解,得到MnSO4溶液,H2O2是还原剂,氧化产物为O2,根据电子守恒、电荷守恒及原子守恒即可得到发生反应的离子方程式;
(3)MnCO3在空气中焙烧得到纯MnO2和CO2,根据电子守恒和原子守恒即可写出发生反应的化学方程式;
(4)Zn2+和Fe3+开始沉淀时溶液的pH不等,可以通过调节溶液pH使Zn2+和Fe3+分离;加H2O2的目的是将酸浸后的Fe2+氧化成Fe3+,便于除去Fe3+;
(5)MnO2与稀硫酸酸化的Na2C2O4溶液反应生成CO2,自身被还原为Mn2+,结合电子守恒和电荷守恒、原子守恒得发生反应的离子方程式;
(1)除去炭包中的碳粉,可以在空气中焙烧,使碳粉在空气中燃烧生成二氧化碳气体即可除去,故选项C符合题意,
故答案为:C;
(2)粗MnO2用用硫酸酸化的H2O2溶液溶解,得到MnSO4和O2,发生反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
(3)MnCO3在空气中焙烧得到纯MnO2和CO2,则发生反应的化学方程式为![]()
![]()
![]() ,
,
故答案为:![]()
![]()
![]() ;
;
(4)加入ZnO可调节溶液pH,使溶液中的Fe3+完全转化为Fe(OH)3沉淀,而Zn2+不沉淀;加入H2O2的目的是将酸浸后的Fe2+氧化成Fe3+,若不加入H2O2溶解,Zn2+和Fe3+开始沉淀时的pH相差不大,无法进行分离,从溶液中获得晶体的方法是蒸发浓缩,冷却结晶,过滤,洗涤,干燥,
故答案为:将溶液中![]() 氧化成
氧化成![]() ;除去溶液中的Fe3+杂质;蒸发浓缩;冷却结晶;过滤;
;除去溶液中的Fe3+杂质;蒸发浓缩;冷却结晶;过滤;
(5)MnO2参与反应的离子方程式为![]() ,
,
故答案为:![]() ;
;

【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法不正确的是___
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2__T1(填“>,<或=”)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是__(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=__。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向___反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__mol。
2NH3(g) △H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__mol。
(6)已知:![]() 2NH3(g) △H=-92kJ/mol
2NH3(g) △H=-92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式__。
【题目】一定温度下,在三个体积均为 2.0L 的恒容密闭容器中发生如下反应:A(g)![]() B(g)+C(g)
B(g)+C(g) ![]() H>0。
H>0。
起始物质的量(mol) | 平衡物质的量(mol) | |||||
容器 | 温度(℃) | A(g) | B(g) | C(g) | 达到平衡所需时间(s) | |
Ⅰ | T1 | 0.20 | 0.10 | 0.10 | t1 | |
Ⅱ | T2 | 0.40 | t2 | |||
Ⅲ | T3 | 0.20 | 0.15 | 0.15 | t3 | |
下列说法正确的是( )
A.达到平衡的时间:t3>t1
B.反应达到平衡时,A 的转化率:容器Ⅱ>容器
C.反应达到平衡时,容器 I 中的平均速率为 v(A)=(0.10/t1)mol/(L·s)
D.T1 时,该反应的平衡常数为 0.05
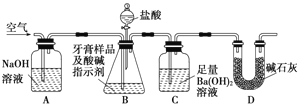
【题目】资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 实验现象 | 结论 |
实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___①______ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量____②_____ | _____③____ | 白色不溶物可能含有猜测2中不溶物 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 _____④____ |
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________。