题目内容
【题目】工业上利用CO与H2反应合成优质燃料甲醇。
(1)已知燃烧6.4g甲醇放出145.16kJ热量,请写出表示甲醇燃烧热的热化学方程式:_______。
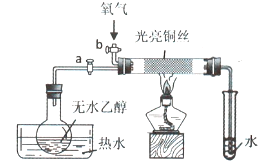
(2)甲醇燃料电池具有能量密度大,对环境污染小等优点,有一种甲醇碱性燃料电池装置如图所示:

①甲醇应由______(选填“a”或“b”)极通入,其电极反应式为___________;
②当电路中通过1.2mol电子时,a极室n(OH-)减少____________mol;
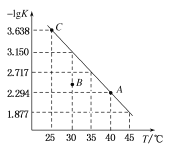
(3)已知:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-129.0 kJ·mol-1,在一恒容密闭容器中,按照a mol CO和2a mol H2投料,测得CO在不同温度下的平衡转化率与压强关系如图所示,则下列说法正确的是____。
CH3OH(g) ΔH=-129.0 kJ·mol-1,在一恒容密闭容器中,按照a mol CO和2a mol H2投料,测得CO在不同温度下的平衡转化率与压强关系如图所示,则下列说法正确的是____。

a.温度:T1>T2>T3
b.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
c.正反应速率:v(a)<v(c)、v(b)>v(d)
d.平衡常数:K(a)<K(c)、K(b)=K(d)
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=725.8kJmol1 a CH3OH-6e-+8OH-=CO32-+6H2O 0.4mol bc
O2(g)=CO2(g)+2H2O(l)△H=725.8kJmol1 a CH3OH-6e-+8OH-=CO32-+6H2O 0.4mol bc
【解析】
(1)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,其中C→CO2(g),H→H2O(l),根据燃烧6.4g甲醇放出145.16kJ热量,计算燃烧1mol甲醇放出的热量,进而写出甲醇燃烧热的热化学方程式;
(2)①原电池中阴离子移动向负极,则a电极为负极,而燃料电池中通入甲醇的一极为负极,则甲醇应由a极通入,电解质环境为碱性环境,则甲醇失电子后生成碳酸根离子;
②负极电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,正极通入氧气,在碱性环境下,正极的电极反应式为O2+4e- +2H2O=4OH-,根据两极OH-的变化结合离子移动判断a极室n(OH-)减少的物质的量;
(3)a. 该反应为放热反应,降温平衡正向移动,CO平衡转化率增大;
b. 平均摩尔质量![]() ,根据质量守恒定律可知,反应过程中气体的总质量不变,各点气体的总质量相等,则
,根据质量守恒定律可知,反应过程中气体的总质量不变,各点气体的总质量相等,则![]() 与
与![]() 成反比;
成反比;
c. 温度越高,反应速率越大,压强越大,反应速率越大;
d. 平衡常数只与温度有关,该反应为放热反应,降温平衡正向移动,平衡常数增大。
(1)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,其中C→CO2(g),H→H2O(l),已知燃烧6.4g甲醇放出145.16kJ热量,则燃烧1mol甲醇放出![]() 的热量,燃烧反应为放热反应,则甲醇燃烧热的热化学方程式为:CH3OH(l)+
的热量,燃烧反应为放热反应,则甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=725.8kJmol1;
O2(g)=CO2(g)+2H2O(l) △H=725.8kJmol1;
故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=725.8kJmol1;
O2(g)=CO2(g)+2H2O(l) △H=725.8kJmol1;
(2)①原电池中阴离子移动向负极,则a电极为负极,而燃料电池中通入甲醇的一极为负极,则甲醇应由a极通入,电解质环境为碱性环境,则甲醇失电子后生成碳酸根离子,其电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:a;CH3OH-6e-+8OH-=CO32-+6H2O;
②负极电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,正极通入氧气,在碱性环境下,正极的电极反应式为O2+4e- +2H2O=4OH-,当电路中通过1.2mol电子时,负极消耗OH-为1.6mol,生成碳酸根离子0.2mol,正极生成1.2mol OH-,为平衡电荷,正极生成的这1.2mol OH-会移动向负极,则a极室n(OH-)减少为1.6mol-1.2mol=0.4mol;
故答案为:0.4mol.;
(3)a. 该反应为放热反应,降温平衡正向移动,CO平衡转化率增大,则温度:T1<T2<T3,A项错误;
b. 平均摩尔质量![]() ,根据质量守恒定律可知,反应过程中气体的总质量不变,各点气体的总质量相等,则
,根据质量守恒定律可知,反应过程中气体的总质量不变,各点气体的总质量相等,则![]() 与
与![]() 成反比,a点和c点相比,a点的CO平衡转化率比c点大,则a点正向进行程度更大,气体物质的量更小,则M(a)>M(c);同理可得,M(b)>M(d),B项正确;
成反比,a点和c点相比,a点的CO平衡转化率比c点大,则a点正向进行程度更大,气体物质的量更小,则M(a)>M(c);同理可得,M(b)>M(d),B项正确;
c. 温度越高,反应速率越大,压强越大,反应速率越大,a点和c点相比,压强相等,温度T1<T3,则正反应速率:v(a)<v(c);b点和d点相比,温度相等,压强Pb>Pd,则v(b)>v(d),C项正确;
d. 平衡常数只与温度有关,该反应为放热反应,降温平衡正向移动,平衡常数增大,由A项知,T1<T2<T3,则平衡常数:K(a)>K(b)=K(d)>K(c),D项错误;
故答案为:bc。

【题目】下列实验操作、现象和结论均正确,且存在对应关系的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将 | 先无现象后产生白色胶状沉淀 |
|
B | 向2支盛有醋酸和硼酸溶液的管中分别滴加 | 醋酸:产生气泡; 硼酸:无现象 |
|
C | 将少量 | 沉淀由红褐色变为白色 |
|
D | 溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 溴乙烷发生消去反应生成了乙烯 |
A.AB.BC.CD.D