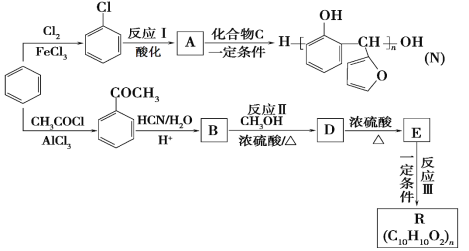
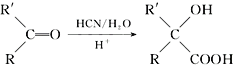题目内容
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
【答案】2CO(g)+SO2(g)= S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1 2 ![]() -1180 kJ·mol-1
-1180 kJ·mol-1
【解析】
根据盖斯定律计算反应热时,通过适当的数学运算得到目标反应,并求出反应热。
(1)①CO(g)+![]() O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
根据盖斯定律,由①2-②可得到2CO(g)+SO2(g)= S(s)+2CO2(g),则ΔH=(-280.0 kJ·mol-1)2-(-290.0 kJ·mol-1)= -270.0 kJ·mol-1,因此,CO、SO2烟道气在催化剂作用下转化为单质S的热化学方程式是2CO(g)+SO2(g)= S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1。
(2)①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
根据盖斯定律,由①2+②可得到4CO(g)+2NO2(g)= N2(g)+4CO2(g) ΔH=-(2a+b)kJ·mol-1。若用标准状况下22.4L CO(物质的量为1mol)还原NO2至N2(CO完全反应),根据碳元素的化合价变化(由+2到+4)可以知道,整个过程中转移电子的物质的量为2mol;由4CO(g)+2NO2(g)= N2(g)+4CO2(g) ΔH=-(2a+b)kJ·mol-1可以计算,放出的热量为![]() kJ。
kJ。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
根据盖斯定律,由①+②可得到2CH4(g)+4NO2(g)==2N2(g)+2CO2(g)+4H2O(g) ΔH=ΔH1+ΔH2。若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,ΔH=-860 kJ·mol-12=-1720 kJ·mol-1,则ΔH2=ΔH -ΔH1=-1720 kJ·mol-1-(-540 kJ·mol-1)= -1180 kJ·mol-1。

 高中必刷题系列答案
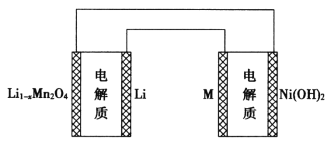
高中必刷题系列答案【题目】气体的自动化检测中常常应用根据原电池原理设计的传感器。下图为电池的工作示意图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。
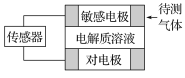
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-===2Cl-
C. 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2和CO体积分数相同的两份空气样本时,传感器上电流大小、方向相同
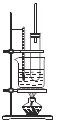
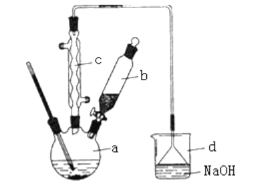
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体,发生的反应方程式______________________________。采用分液漏斗滴加溴的方式,这样的好处是_______________;c的作用_________________; 冷凝水的方向是________________(填写“上进下出”或者“下进上出”);
(2)液溴滴完后,经过下列步骤分离提纯:
(a)向a中加入10mL水,然后通过过滤除去未反应的铁屑;
(b)滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_________;
(c)向分出的粗溴苯中加入少量的无水硫酸镁,静置、过滤。加入硫酸镁的目的是_____;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是___(填入正确选项前的字母)。
a.25mL b.50mL c.250mL d.500mL