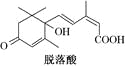
��Ŀ����
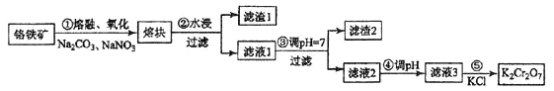
����Ŀ��ij��ʯ��Ҫ�ɷ��д�����(Fe3O4)���̿�(MnO2��MnCO3)��������(Al2O3)��ʯ��Mg3Si3O7(OH)4�ȡ������̿������ڴ�����������ҵ�Ͻ��ÿ�ʯ��������ȡ���Ĺ�ҵ�������£�

��֪����������������ˮ��ϡ���ᣬ������Ũ���ᡣ̼���̲�����ˮ������ϡ���ᡣ
(1)MnO2��MnCO3�У�MnԪ�صĻ��ϼ۷ֱ���_________��
(2)ʯ��ѧʽΪMg3Si3O7(OH)4���������ᷴӦ�Ļ�ѧ����ʽΪ_________��
(3)����AΪ____________(�ѧʽ)
(4)������м����������Ƶ�������_________��
(5)��֪��ͬ����������������������������pH�����
���� | Fe3+ | Al3+ | Fe2+ | Mg2+ | Mn2+ |
��ʼ������pH | 2.7 | 3.7 | 7.0 | 9.3 | 7.8 |
��ȫ������pH | 3.7 | 4.7 | 9.6 | 10.8 | 9.8 |
������м����������Ƶ�����Һ��pH����11��������B�ijɷ���________��
(6)�����������Һ�м���һ�����ʺ���ˣ�����������__________�����˲�����ʹ�õIJ���������©����_________����D����Ʊ����Ļ�ѧ����ʽΪ_____________��
���𰸡�+4��+2 Mg3Si3O7(OH)4+3H2SO4=3MgSO4+3H2SiO3��+2H2O MnO2��H2SiO3 ��Fe3+��Fe2+��Mg2+��Mn2+ת��Ϊ������ʹAl3+ת��ΪAlO2�� Fe(OH)3��Mg(OH)2��Mn(OH)2 CO2 �ձ��������� 2Al2O3![]() 4Al+O2��
4Al+O2��
��������
(1)��������Ԫ�ػ��ϼ�֮��Ϊ0��
(2)ʯ�������ﻯѧʽΪ��3MgO3SiO22H2O���ݴ˷�����
(3)��������Ҫ�ɷ��Dz����������ˮ�����ʣ�
(4)������������Һ���������ҺpHֵ��ʹ�������ӱ�Ϊ������
(5)���ݱ������ݽ��з�����ע�����������������ܽ⣻
(6)��ƫ������ת���ɳ����ķ�����ͨ����������̼��������Ҫ©�������������ձ���
(1)MnO2����Ԫ��Ϊ-2�ۣ�����MnΪ+4�ۣ�MnCO3����Ԫ��Ϊ-2�ۣ�̼Ԫ��Ϊ+4�ۣ�����MnԪ��Ϊ+2�ۣ��ʴ�Ϊ��+4��+2��
(2)ʯ�������ﻯѧʽΪ��3MgO3SiO22H2O�������ᷴӦ��������þ����������ʴ�Ϊ��Mg3Si3O7(OH)4+3H2SO4=3MgSO4+3H2SiO3��+2H2O��
(3)����(2)��֪�����˲�������Ĺ��ᣬͬʱ������Ŀ������Ϣ��֪MnO2������ˮ��ϡ���ᣬ�ʴ�Ϊ��MnO2��H2SiO3��
(4)�������˺���Һ�д���Fe3+��Fe2+��Mg2+��Mn2+��Al3+�����ӣ������������ƿ��Խ�Fe3+��Fe2+��Mg2+��Mn2+ת��Ϊ������ͬʱ����ʹAl3+ת��ΪAlO2-���ʴ�Ϊ����Fe3+��Fe2+��Mg2+��Mn2+ת��Ϊ������ʹAl3+ת��ΪAlO2-��
(5)������Ŀ���������֪����pH=11ʱ�����н������Ӷ��Ѿ�������AlԪ����AlO2-����ʽ���ڣ�Fe2+�������Ѹ�ٱ��������ʴ�Ϊ��Fe(OH)3��Mg(OH)2��Mn(OH)2��
(6)ƫ��������Һ��ͨ�������̼�����������������������Ҳ����ܽ⣻������Ҫ©�������������ձ�����ҵ�ϵ����������ȡ�����ʣ�����ʽΪ��2Al2O3![]() 4Al+O2�����ʴ�Ϊ��CO2���ձ�����������2Al2O3
4Al+O2�����ʴ�Ϊ��CO2���ձ�����������2Al2O3![]() 4Al+O2����
4Al+O2����

����Ŀ��ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�顣�������������գ�
����һ������250mL 0.1000mol/L NaOH����Һ��
�������ȡ20.00mL����ϡ���������ƿ�У����μ�2��3�η�̪��Һ��ָʾ�������Լ����Ƶı�NaOH��Һ���еζ����ظ������ζ�����2�Σ���¼�������¡�
ʵ���� | NaOH��Һ��Ũ�ȣ�mol/L�� | �ζ����ʱ������NaOH��Һ�������mL�� | ����������Һ�������mL�� |
1 | 0.1000 | 20.02 | 20.00 |
2 | 0.1000 | _______ | 20.00 |
3 | 0.1000 | 19.98 | 20.00 |
��1������һ��Ҫ�����������ƹ��������Ϊ__________g�����Ʊ���Һ��Ҫ�õ����������ձ��⣬����Ҫ�IJ���������__________________��
��2�����������ȡ20.00mL��ϡ�����õ���������__________���жϵζ��յ��������_____
��3��ʵ��2���ζ�ǰҺ������0���̶ȴ����ζ���Һ����ͼ��ʾ�������Ϊ________mL�������������ݣ��ɼ�����������Ũ��Ϊ__________��

��4��������ʵ���У����в���������������ȷ������ɲⶨ���������ҺŨ��ֵ��ƫ�ߵ�����_______��
A. ���Ʊ���Һ����ʱ�����ӿ̶���
B. ��ƿˮϴ��ֱ��װ����Һ
C. ��ʽ�ζ���ˮϴ��δ�ô���ϡ������Һ��ϴ
D. �ζ������յ�ʱ�����Ӷ����ζ��ܶ�����
E. ��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ