题目内容
下列说法不正确的是
| A.在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
| B.一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023 |
| C.100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl— 的个数为0.6×6.02×1023 |
| D.含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L |
D
解析试题分析:A、氧原子守恒,80g SO3为1 mol,含氧原子3 mol;B、生成1 mol氢气转移电子2mol,8.96L H2为0.4 mol,所以转移电子0.8 mol;C、1mol/L AlCl3与3mol/L NaCl中Cl—浓度均为3mol/L,n(Cl-)="0.6" mol;D、Na2O2的电子式为 ,含有非极性键的数目为6.02×1023的Na2O2为1 mol,根据方程式:2Na2O2+2H2O=4NaOH+O2↑可得生成氧气11.2L,故D不正确。
,含有非极性键的数目为6.02×1023的Na2O2为1 mol,根据方程式:2Na2O2+2H2O=4NaOH+O2↑可得生成氧气11.2L,故D不正确。
考点:考查阿伏伽德罗常数。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知标准状况下:①6.72L CH4 ②3.01×1023HCl ③23.1g CCl4 ④2.3g Na,下列对四种物质的
关系由小到大表示正确的是
| A.体积④<①<②<③ | B.密度①<④<③<② |
| C.原子数④<③<②<① | D.质量④<①<③<② |
下列有关化学用语的表述正确的是
A.质子数与中子数相等的氢原子符号: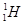 |
| B.蔗糖和麦芽糖的分子式:C12H22O11 |
| C.乙烯的结构简式:CH2CH2 |
D.35Cl-、37Cl-的结构示意图: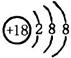 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温常压下,22.4 L CH4中含有4 nA个C-H键 |
| B.1 mol Fe与足量稀硝酸反应,转移2 nA个电子 |
| C.0.5 mol·L-1 FeCl3溶液中含有1.5 nA个Cl- |
| D.常温下,22g CO2含有nA个氧原子 |
对于同温同压条件下的气体12C18O与14N2,判断正确的是
| A.体积相等时密度相等 | B.原子数相等时中子数相等 |
| C.体积相等时电子数相等 | D.质量相等时质子数相等 |
工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用相同条件下的NH3 3L恰好反应完全,则混合气中NO与NO2的体积分数比
| A.l:4 | B.1:3 | C.l:2 | D.l:l |
NA表示阿伏伽德罗常数。下列判断正确的是
| A.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B.分别为7.8g的Na2S和Na2O2中含有的阴离子数分别是0.1NA和0.2NA |
| C.常温常压下,22.4LCO2中含有的CO2分子数小于NA个 |
| D.1L0.1mol/L的氨水含有0.1NA个NH3·H2O |
下列化学用语错误的是( )
A.羟基电子式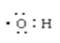 |
| B.乙烯的结构简式CH2CH2 |
| C.乙酸的实验式CH2O |
D.3,3-二甲基-1-戊烯的键线式: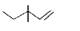 |