题目内容
【题目】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:
(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O((1)△H=-44.0kJ/mol,则a=_____________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=_____________kJ/mol。
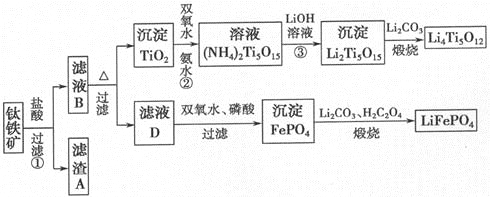
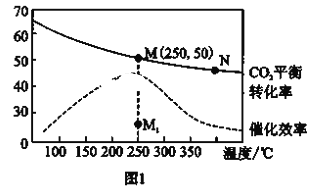
(2)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是_____________。
A.平衡常数大小: KM < KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
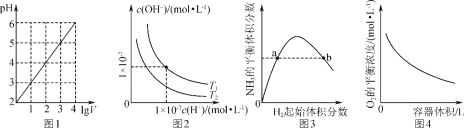
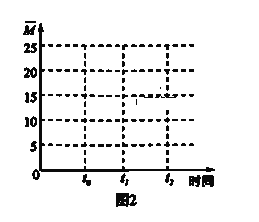
(3)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象。___________
随时间变化的图象。___________
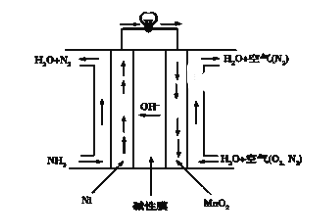
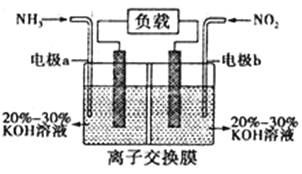
Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
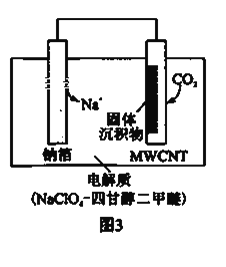
(4)放电时,正极的电极反应式为______。
(5)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g
【答案】127.8 AC 
![]() 11.2g
11.2g
【解析】
(1)由H2和CH2=CH的燃烧热和H2O(g)![]() H2O((1)△H=-44.0kJ/mol,计算2CO2(g)+6H2(g)
H2O((1)△H=-44.0kJ/mol,计算2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol;
CH2=CH2(g)+4H2O(g) △H=akJ/mol;
(2)A.反应是放热反应,温度升高平衡逆向进行;
B.根据图象分析;
C.图中M点时二氧化碳的转化率50%,结合化学平衡三行计算列式得到;
D.混合气体的质量不变,体积不变,所以混合气体的密度始终不变;
(3)反应前混合气体的平均相对分子质量![]() =12.5,随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,t1时将容器体积瞬间扩大至2VL,平衡向逆方向移动,t2时重新达平衡;
=12.5,随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,t1时将容器体积瞬间扩大至2VL,平衡向逆方向移动,t2时重新达平衡;
(4)据正极得电子发生还原反应书写电极方程式;
(5)据电极方程式得到两极的质量,进而求质量差。
(1)![]() ;
;![]() ;
;![]() ;
;
将方程式![]() 得
得![]() ;
;
故答案为:-127.8;
(2)A.升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故A正确;
B.由图象可知,其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M,故B错误;
C.若在密闭容器中充入体积比为 3:1的 H2 和CO2,设为3mol、1mol,则图中M点时二氧化碳转化率50%,
![]()
起始量 3 1 0 0
变化量 1.5 0.5 0.25 1
平衡量 1.5 0.5 0.25 1
产物C2H4的体积分数=![]() ×100%=7.7%,故图1中M点时,乙烯的体积分数为7.7%,故C正确;
×100%=7.7%,故图1中M点时,乙烯的体积分数为7.7%,故C正确;
D.混合气体的质量不变,体积不变,所以混合气体的密度始终不变,所以不能根据混合气体的密度来判断化学反应是否达到平衡状态,故D错误,故答案为:AC;
(3)反应前混合气体的平均相对分子质量![]() =12.5,所以起点坐标为(0,12.5),随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,若全部转化为CH2=CH2和H2O平均相对分子质量=
=12.5,所以起点坐标为(0,12.5),随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,若全部转化为CH2=CH2和H2O平均相对分子质量=![]() =20,则t0达平衡时M应在区间(12.5,20),t1时将容器体积瞬间扩大至2VL,平衡向逆方向移动,t2时重新达平衡,平均相对分子质量减小,t2达平衡时M应大于12.5,所以图象为
=20,则t0达平衡时M应在区间(12.5,20),t1时将容器体积瞬间扩大至2VL,平衡向逆方向移动,t2时重新达平衡,平均相对分子质量减小,t2达平衡时M应大于12.5,所以图象为 。
。
(4)正极![]() 得电子发生还原反应,故电极方程式
得电子发生还原反应,故电极方程式![]() ;
;
故答案为:![]() ;
;
(5)正极发生的电极反应![]() ,
,![]() ,所以正极增加质量为11.2g;
,所以正极增加质量为11.2g;
故答案为11.2g。

【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)