题目内容
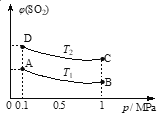
【题目】固体A在一定温度下分解生成气体B、C、D反应为:2A![]() B+2C+3D,若测得生成气体的质量是相同体积的H2的15倍,则固体A的摩尔质量是( )
B+2C+3D,若测得生成气体的质量是相同体积的H2的15倍,则固体A的摩尔质量是( )
A. 30 g/mol B. 60 g/mol
C. 90 g/mol D. 120 g/mol
【答案】C
【解析】试题分析:令A的物质的量为2mol,由方程式2A=B+2C+3D,可知混合气体总物质的量为1mol + 2mol + 3mol = 6mol,混合气体对氢气的相对密度为15,则混合气体平均摩尔质量=2g/mol×15=30g/mol,混合气体总质量=6mol×30g/mol=180g,由质量守恒定律可知A的质量等于混合气体总质量,故A的摩尔质量=![]() =90g/mol,故选C。
=90g/mol,故选C。

练习册系列答案
相关题目
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3 - |
B | 用洁净的铂丝蘸取某溶液在火焰上灼烧,观察到火焰显黄色 | 该溶液中一定存在Na+,一 定没有K+ |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和 0.1mol/L CH3COONa 溶液的pH | 比较HC1O 和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A. A B. B C. C D. D