题目内容
1.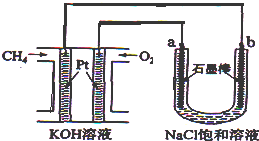 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示.回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示.回答下列问题:(1)甲烷燃料电池正极、负极的电极反应分别为2O2+4H2O+8e-=8OH-,CH4+10OH--8e-=CO32-+7H2O.
(2)b电极上得到的气体是H2,电解氯化钠溶液的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)若甲烷通入量为1L(标准状况),且反应完全,则最多能产生的氯气体积为4 L(标准状况).
(4)以甲醇(CH3OH)为燃料的电池中,电解质溶液为酸性,则正极、负极的电极反应分别为O2+4e-+4H+=2H2O,CH3OH+H2O-6e-═CO2+6H+.
分析 (1)甲烷碱性燃料电池中正极氧气得电子被还原,负极甲烷失电子被氧化;
(2)b连接电源的负极,应为阴极,生成氢气;电解氯化钠溶液生成氢气、氯气和氢氧化钠;
(3)根据关系式1 mol CH4~8 mol e-~4 mol Cl2计算;
(4)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水.
解答 解:(1)在碱性溶液中,甲烷燃料电池的总反应式为:CH4+2O2+2OH-=CO32-+3H2O,正极是:2O2+4H2O+8e-═8OH-,负极是:CH4-8e-+10OH-═CO32-+7H2O.
故答案为:2O2+4H2O+8e-=8OH-;CH4+10OH--8e-=CO32-+7H2O;
(2)b电极与通入甲烷的电极相连,作阴极,是H+放电,生成H2;电解氯化钠溶液的总反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:H2;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)根据得失电子守恒,可得:1 mol CH4~8 mol e-~4 mol Cl2,故若每个电池甲烷通入量为1 L(标准状况),生成4L Cl2,故答案为:4;
(4)甲醇燃料电池酸性条件下该燃料电池的正极反应式为O2+4e-+4H+=2H2O,电池负极反应式为:CH3OH+H2O-6e-═CO2+6H+;故答案为:O2+4e-+4H+=2H2O;CH3OH+H2O-6e-═CO2+6H+.
点评 本题涵盖电解池和原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

| A. | 现象①-浓硫酸吸水放热 | |
| B. | 现象②-浓硫酸具有脱水性使蔗糖炭化 | |
| C. | 现象③-浓硫酸具有强氧化性,发生反应:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| D. | 若将③中气体通入澄清石灰水中,出现白色浑浊,可证明气体中存在CO2 |
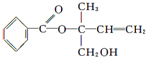
| A. | X的分子式为C12H14O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 | |
| D. | 可用酸性高锰酸钾溶液区分苯和X |
(1)电解氯化钠饱和溶液可以制得多种化工原料,写出电解氯化钠溶液的化学方程式:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.用其中两种原料可以制备常见的消毒剂,
请写出制备反应的离子反应方程式Cl2+2OH-=Cl-+ClO-+H2O.
(2)①若MgCl2粗产品中含有Mg2+、Fe2+、Fe3+、Mn2+ 等阳离子,需先将 Fe2+、Fe3+、Mn2+ 转化为沉淀除去,Fe(OH)2为絮状,常将Fe2+转化为Fe(OH)3除去,若只加入(1)中制备消毒剂时的产物之一,则所加物质的化学式为NaClO,控制溶液的pH为9.8. 请写出该物质与溶液中Fe2+ 反应的离子方程式:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3↓+Cl-.
| 物质 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 7.6 | 2.7 | 8.3 | 9.9 |
| 沉淀完全 | 9.6 | 3.7 | 9.8 | 11.1 |
(3)如图2为某同学设计的从海带中提取碘单质的流程图.
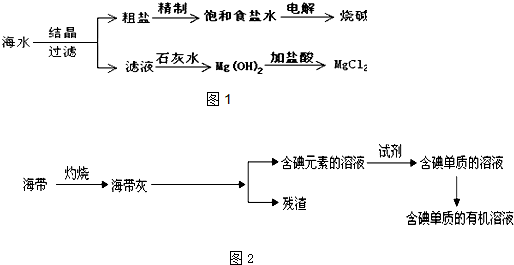
①请写出从海带灰提取碘元素时用到的主要仪器的名称铁架台、烧杯、玻璃棒、漏斗;
②将溶液中的碘元素的转化为碘单质可以用H2O2稀H2SO4试剂,请写出发生反应的离子方程式H2O2+2I-+2H+=I2+2H2O,
含碘单质CCl4溶液呈现紫红色.
 某研究小组用HNO2与大理石的反应来研究影响反应速度的因素,所用HNO2浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO2的用量为25.0mL、大理石用量为10.00g.
某研究小组用HNO2与大理石的反应来研究影响反应速度的因素,所用HNO2浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO2的用量为25.0mL、大理石用量为10.00g.(1)请完成以下实验,并在实验目的一栏中回答有关问题:
| 实验编号 | T/K | 大理石 规格 | C(HNO2)/mol.L | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | Ⅰ、实验①和②探究浓度对该反应速率的影响; Ⅱ、实验①和实验③探究温度对该反应速率的影响; Ⅲ、实验①和实验④探究大理石规格(粗、细)对该反应速率的影响. |
② | 298 | 粗颗粒 | 1.00 | |
| ③ | ||||
| ④ |
| A. | 1,4-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-乙基戊烷 | D. | 4-甲基-3-乙基辛烷 |
| A. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-═CaCO3↓+SO42- | |
| B. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| C. | 铂电极电解MgCl2饱和溶液:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| D. | H+(aq)+OH(aq)═H2O(1);△H=-57.3 kJ/mol,表示含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
| A. | 甲醇、乙二醇 | B. | 甲酸乙酯和乙酸甲酯 | ||
| C. | 蚁酸和乙酸 | D. | 苯酚( -OH)和甲苯( -OH)和甲苯( -CH3) -CH3) |
| A. | Fe2O3 | B. | Fe(OH)3 | C. | FeO | D. | Fe3O4 |