题目内容
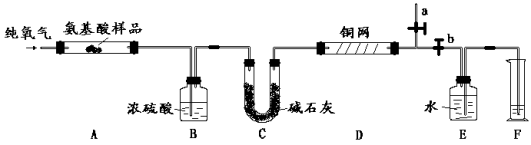
【题目】某化学兴趣小组利用如图所示装置对SO2的性质进行实验研究。
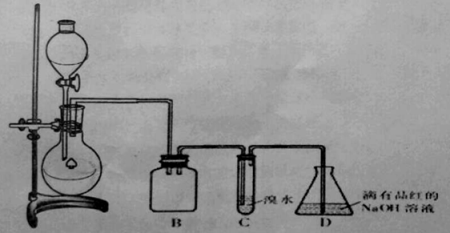
请回答下列问题:
(1)装置B的作用是 。
(2)装置C的目的是检验SO2 性。装置D中NaOH全部转化为NaHSO3的标志是 。
(3)向装置D所得NaHSO3溶液中加入漂白粉,有三种可能的情况:
I.HSO3-与ClO-刚好反应完 II.漂白粉不足 III.漂白粉过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定属于哪一种情况,请完成下表。
(已知酸性:H2SO4>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 可能的情况 |
① | 滴加少量淀粉-KI溶液,振荡 | III | |
② | 滴加少量溴水,振荡 | II | |
③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(4)该小组同学认为,SO2通入含有BaCl2的双氧水中会出现白色沉淀,该反应的离子方程式为 。
【答案】
(1)防止倒吸
(2)还原 品红褪色
(3)①溶液变蓝 ②溴水褪色 ③I ④I或II
(4)SO2+Ba2++H2O2=BaSO4↓+2H+
【解析】
试题分析:该装置的目的是制取SO2并研究其性质。由此可知第一部分为SO2的发生装置,将产生的SO2通入溴水中可验证SO2的还原性,但由于SO2易溶于水,故需考虑防倒吸。据此分析,可知:
(1)装置B起安全瓶的作用,防倒吸。
(2)装置C的目的是检验SO2还原性。装置D中NaOH可用于验证SO2酸性氧化物的性质,当NaOH全部转化为NaHSO3时,此时继续通入的SO2能使品红褪色。
(3)装置D所得NaHSO3溶液中加入漂白粉,发生的反应为HSO3- +ClO- = SO42- + Cl- + H+ ,Ca2+ + SO42- = CaSO4↓。①当漂白粉过量时,滴加少量淀粉-KI溶液,振荡,漂白粉能将I-氧化为I2,I2遇淀粉溶液变蓝;②当漂白粉不足时,原溶液中还存在过滤的NaHSO3溶液,滴加少量溴水,振荡,溴水被还原,表现为溴水褪色;③滴加少量酸性KMnO4溶液,振荡,溶液呈紫色,说明酸性KMnO4溶液未参与反应,即原NaHSO3溶液与漂白粉刚好反应完;④加入几小块CaCO3固体,有气泡产生,说明溶液中有H+剩余,根据上述分析,无论是I或II,溶液都呈酸性。
(4)双氧水将SO2氧化为SO42-,SO42-与BaCl2反应产生白色沉淀,即:SO2+Ba2++H2O2=BaSO4↓+2H+。

【题目】某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究。
实验编号 | 反 应 物 | 催 化 剂 |
甲 | 试管中加入3 mL 2﹪ H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5﹪ H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5﹪ H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol/L FeCl3溶液 |
丁 | 试管中加入3 mL 5﹪ H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol/L FeCl3溶液 |
戊 | 试管中加入3 mL 5﹪ H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol/L FeCl3溶液 |
【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5﹪的H2O2溶液加热到65℃时就有氧气放出,加热到80℃时就有较多氧气产生。
(1)上述实验发生反应的化学方程式为 。
(2)实验甲和实验乙的实验目的是 ;
实验丙、实验丁和实验戊的实验目的是 。
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的? 。
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验戊,0~20 s的反应速率v1= mL/s,100~120 s的反应速率v2= mL/s。
不考虑实验测量误差,二者速率存在差异的主要原因是 。
②如右图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验 (填“丙”、“丁”或“戊”)。