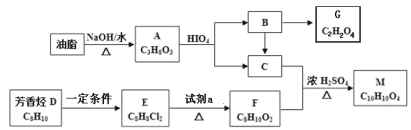
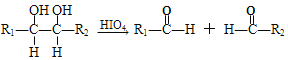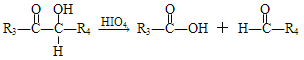题目内容
【题目】实验室用燃烧法测定某种α- 氨基酸X (CxHyOzNp)的分子组成。取3.34 g X放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
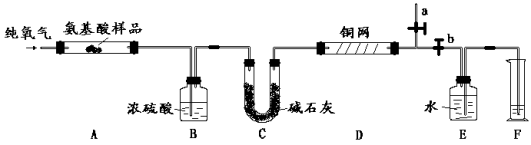
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧气,这样做的目的是 ;之后则需关闭止水夹a,打开止水夹b。
(2)上述装置中A、D处都需要用酒精灯加热,操作时应先点燃 处的酒精灯。
(3)装置D的作用是 。
(4)实验结果:
①B中浓硫酸增重1.62 g,C中碱石灰增重7.04 g,F中收集到224 mL气体(标准状况)。
②X的相对分子质量为167,它是通过 测定的(填一种现代化学仪器)
试通过计算确定该有机物X的分子式(写出计算过程)。
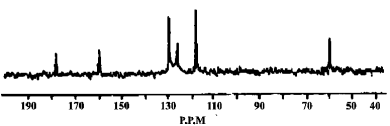
(5)另取3.34 g X与0.2 mol/L 的NaOH溶液反应,最多能中和NaOH溶液200 mL,有机物X的13C-NMR(即核磁共振碳谱,其作用与核磁共振氢谱类似)如下图所示。试确定有机物X的结构简式为 。
【答案】(1)将装置中的N2排尽
(2) D
(3)吸收未反应的O2,保证最终收集到的气体是反应生成的N2
(4)质谱仪C8H9O3N (算出CO2、H2O、N2各得1分,算出O得1分,求出分子式得1分,共5分)
(5)![]()
【解析】
试题分析:该实验原理为3.34g该种氨基酸放在纯氧中充分燃烧生成CO2、H2O和N2,装置B内盛放浓硫酸,吸收生成的水,根据装置B増重确定3.34g·该种氨基酸中含氢元素质量;根据C中碱石灰的増重可确定碳元素的质量;装置D用于除去未反应的氧气,根据F'中水的体积确定氮气的体积并由此确定待测氨基酸中含有的氮元素的质量,最后计算氨基酸中氧元素的质量,确定分子中各元素原子个数比,由此确定最简式。
(1)装置的空气中含有N2,影响生成氮气的体积测定,需先通入氧气将装置中的氮气排尽。
(2)应先点燃D处的酒精灯吸收未反应的氧气,保证最后收集的气体为纯净的氮气。
(3)由原理可知,气体进入装置E之前应该先将氧气除去,所以铜网的作用是吸收未反应的O2,保证最终收集到的气体是反应生成的N2。
(4)有机物相对分子质量的测定用质谱仪;B中浓硫酸增重1.62 g,为生成水的质量,则水的物质的量为0.09mol,氢原子的物质的量为0.18mol,氢元素的质量为0.18g;C中碱石灰增重7.04 g,为生成二氧化碳的质量,则二氧化碳的物质的量为0.16mol,碳原子的物质的量为0.16mol,碳元素的质量为1.92g,F中收集到224 mL气体(标准状况),为氮气,物质的量为0.01mol,氮原子的物质的量为0.02mol,氮元素的质量为0.28g;则氨基酸中氧元素的质量为3.34g-0.18g-1.92g-0.28g=0.96g,氧原子的物质的量为0.06mol;则该有机物的最简式为C8H9O3N,相对分子质量为167,则该有机物的分子式为C8H9O3N。
(5)3.34 g X的物质的量为0.02mol,与0.2 mol/L 的NaOH溶液反应,最多能中和NaOH溶液200 mL,即消耗0.04molNaOH,则该有机物中含有1个羧基、1个酚羟基,根据有机物X的13C-NMR确定有机物中含有6种碳原子,则苯环上含有两个取代基,且位于对位,则有机物X的结构简式为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组利用如图所示装置对SO2的性质进行实验研究。
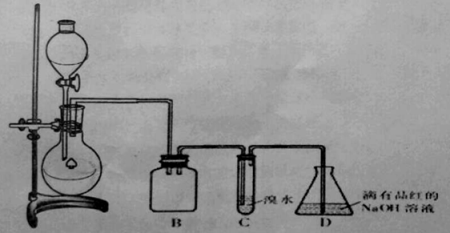
请回答下列问题:
(1)装置B的作用是 。
(2)装置C的目的是检验SO2 性。装置D中NaOH全部转化为NaHSO3的标志是 。
(3)向装置D所得NaHSO3溶液中加入漂白粉,有三种可能的情况:
I.HSO3-与ClO-刚好反应完 II.漂白粉不足 III.漂白粉过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定属于哪一种情况,请完成下表。
(已知酸性:H2SO4>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 可能的情况 |
① | 滴加少量淀粉-KI溶液,振荡 | III | |
② | 滴加少量溴水,振荡 | II | |
③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(4)该小组同学认为,SO2通入含有BaCl2的双氧水中会出现白色沉淀,该反应的离子方程式为 。