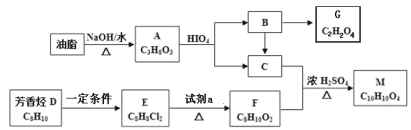
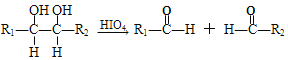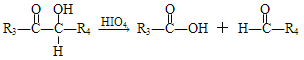题目内容
【题目】煤燃烧排放的烟气中(主要含SO2、CO2)的SO2形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
(1)采用Ca(ClO)2烟气脱硫可得到较好的效果。已知下列反应:
①SO2(g)+2OH (aq) =SO32 (aq)+H2O(l) ΔH1
②ClO (aq)+SO32 (aq) =SO42 (aq)+Cl (aq) ΔH2
③CaSO4(s) =Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) = CaSO4(s) +H2O(l) +Cl (aq)的ΔH=_ 。
(2)采用氨水烟气脱硫,最终可得到氮肥。将相同物质的量的SO2与NH3溶于水所得溶液中c(H+)﹣c(OH-)= (填字母编号).
A.c(SO32-)﹣c(H2SO3)
B.c(SO32-)+c(NH3·H2O)﹣c(H2SO3)
C.c(HSO3-)+c(SO32-)﹣c(NH4+)
D.c(HSO3-)+2c(SO32-)﹣c(NH4+)
(3)烟气在较高温度经下图方法脱除SO2,并制得H2SO4。
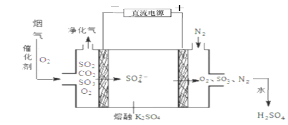
①在阴极放电的物质是 。
②在阳极生成SO3的电极反应式是 。
③已知室温下,Ksp(BaSO4)=1.1×10-10。将脱除SO2后制得的H2SO4配成pH=4 的H2SO4溶液,与pH=9的 Ba(OH)2 溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2 溶液与 H2SO4 溶液的体积比为 。欲使溶液中c(SO42-) =2.0×10-4mol·L-1,则应保持溶液中 c(Ba2+) = mol·L-1。
(4)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂,利用如下反应回收燃煤烟气中的硫。反应为:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ΔH= - 270KJ·mol-1其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择_ 为该反应的催化剂较为合理(选填序号)。
2CO2(g)+S(l) ΔH= - 270KJ·mol-1其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择_ 为该反应的催化剂较为合理(选填序号)。

a. Cr2O3 b. NiO c. Fe2O3
选择该催化剂的理由是:_ 。
某科研小组用选择的催化剂,在380℃时,研究了n(CO) : n(SO2)分别为1:1
【答案】(1)△H1+△H2-△H3(2)B D
(3)① O2 ② 2SO42――4e-= 2SO3↑ + O2↑
③10:1 5.5×10-7
(4)c ; Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源;a
【解析】
试题分析:(1)根据盖斯定律:①+②-③得反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) = CaSO4(s) +H2O(l) +Cl (aq)的ΔH=△H1+△H2-△H3。
(2)根据反应:SO2+NH3+H2O![]() NH4HSO3知将相同物质的量的SO2与NH3溶于水所得溶液为NH4HSO3溶液,溶液中存在电荷守恒:c(HSO3-)+2c(SO32-)+c(OH-)=c(H+)+c(NH4+),c(H+)﹣c(OH-)=c(HSO3-)+2c(SO32-)﹣c(NH4+),D正确,C错误;溶液中存在物料守恒:c(NH4+)+ c(NH3·H2O)=c(HSO3-)+c(SO32-)+c(H2SO3),结合电荷守恒和物料守恒可知c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)=c(SO32-)+ c(NH3·H2O)-c(H2SO3),所以A错误,B正确,选BD。
NH4HSO3知将相同物质的量的SO2与NH3溶于水所得溶液为NH4HSO3溶液,溶液中存在电荷守恒:c(HSO3-)+2c(SO32-)+c(OH-)=c(H+)+c(NH4+),c(H+)﹣c(OH-)=c(HSO3-)+2c(SO32-)﹣c(NH4+),D正确,C错误;溶液中存在物料守恒:c(NH4+)+ c(NH3·H2O)=c(HSO3-)+c(SO32-)+c(H2SO3),结合电荷守恒和物料守恒可知c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)=c(SO32-)+ c(NH3·H2O)-c(H2SO3),所以A错误,B正确,选BD。
(3)根据图示知该装置为电解池,总反应为2SO2+O2![]() 2SO3,SO3+H2O
2SO3,SO3+H2O![]() H2SO4。①电解池的阴极发生还原反应,故在阴极放电的物质是O2。②在阳极生成SO3的电极反应式是2SO42――4e-= 2SO3↑ + O2↑。③设氢氧化钡溶液的体积为V1,硫酸溶液的体积为V2,根据题意知10-5mol/LV1=10-4mol/LV2,则V1:V2=10:1;已知室温下,Ksp(BaSO4)=1.1×10-10。欲使溶液中c(SO42-) =2.0×10-4mol·L-1,则应保持溶液中 c(Ba2+) =Ksp(BaSO4)/ c(SO42-)= 5.5×10-7mol·L-1。
H2SO4。①电解池的阴极发生还原反应,故在阴极放电的物质是O2。②在阳极生成SO3的电极反应式是2SO42――4e-= 2SO3↑ + O2↑。③设氢氧化钡溶液的体积为V1,硫酸溶液的体积为V2,根据题意知10-5mol/LV1=10-4mol/LV2,则V1:V2=10:1;已知室温下,Ksp(BaSO4)=1.1×10-10。欲使溶液中c(SO42-) =2.0×10-4mol·L-1,则应保持溶液中 c(Ba2+) =Ksp(BaSO4)/ c(SO42-)= 5.5×10-7mol·L-1。
(4)分析图1知Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源,故用Fe2O3作催化剂;增大CO的浓度,平衡正向移动,SO2的平衡转化率增大,则图2中表示n(CO) : n(SO2)=3:1的变化曲线为a。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥剂
C.六水合氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
【题目】某化学兴趣小组利用如图所示装置对SO2的性质进行实验研究。
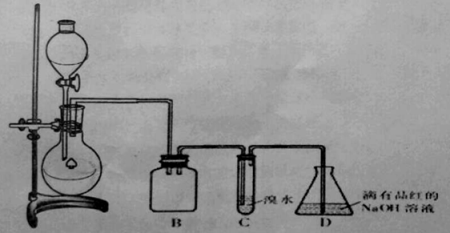
请回答下列问题:
(1)装置B的作用是 。
(2)装置C的目的是检验SO2 性。装置D中NaOH全部转化为NaHSO3的标志是 。
(3)向装置D所得NaHSO3溶液中加入漂白粉,有三种可能的情况:
I.HSO3-与ClO-刚好反应完 II.漂白粉不足 III.漂白粉过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定属于哪一种情况,请完成下表。
(已知酸性:H2SO4>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 可能的情况 |
① | 滴加少量淀粉-KI溶液,振荡 | III | |
② | 滴加少量溴水,振荡 | II | |
③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(4)该小组同学认为,SO2通入含有BaCl2的双氧水中会出现白色沉淀,该反应的离子方程式为 。