题目内容
【题目】常温下,0.1 mol/L CH3COONa溶液pH=9,则下列说法正确的是
A. 加入少量NaOH固体后溶液pH小于9
B. 加水稀释,CH3COONa水解程度增大,c(OH-)增大
C. 该溶液水电离出的c(OH-)=10-9
D. CH3COOH在常温下Ka数值约为1×10-5
【答案】D
【解析】
A.加入少量NaOH固体后虽然抑制了水解平衡,但NaOH本身电离出大量OH-,溶液的pH大于9,故A错误;
B.加水稀释,CH3COONa水解程度增大,但c(OH-)减小,故B错误;
C.CH3COO-的水解是促进水的电离,溶液中水电离出的c(OH-)=10-5mol/L,故C错误;
D.常温下,0.1 mol/L CH3COONa溶液pH=9,醋酸平衡常数Ka需要水解平衡常数计算,CH3COO-+H2O![]() CH3COOH+OH-,Kh=
CH3COOH+OH-,Kh=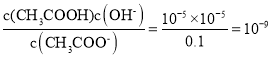 ,Ka=
,Ka=![]() =1×10-5,故D正确;
=1×10-5,故D正确;
答案为D。

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目