题目内容
14.如图所示为血红蛋白和肌红蛋白的活性部分---血红素的结构: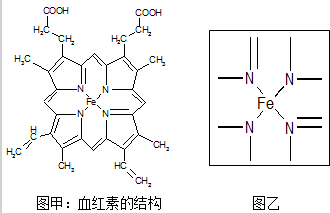
回答下列问题:
(1)根据元素电负性请判断H2N-CHO中碳和氮的化合价分别为+2和-3.
(2)血红素中两种氮原子的杂化方式分别为sp2,sp3;在图乙的方框内用“→”标出亚铁离子的配位键.
分析 (1)H2N-CHO中,N的非金属性比C强,则C、O化合价为负价,H和C为正价,结合化合价代数和为0计算元素的化合价;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的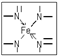 ,若都为单键,则该氮原子为sp3杂化.
,若都为单键,则该氮原子为sp3杂化.
解答 解:(1)H2N-CHO中,N的非金属性比C强,则C、O化合价为负价,H和C为正价,C的化合价为+2价,N的化合价为-3价,故答案为:+2;-3;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的 ,若都为单键,则该氮原子为sp3杂化,如NH4+,
,若都为单键,则该氮原子为sp3杂化,如NH4+,
故答案为:sp2;sp3;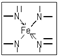 .
.
点评 本题考查较为综合,涉及化合价、杂化方式等问题,题目难度较大,注意基础知识的积累.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
4.下列反应的离子方程式书写正确的是( )
| A. | NaHCO3溶液和盐酸;CO32-+2H+═H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | 向碳酸氢铵溶液中加过量的氢氧化钠溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用MnS除去MnCl2溶液中的Cu2+:MnS+Cu2+=CuS+Mn2+ |
5.工业上用软锰矿(主要成分是二氧化锰)制取高锰酸钾和软磁铁氧体材料MnxO4,其流程如下(部分条件和产物省略):
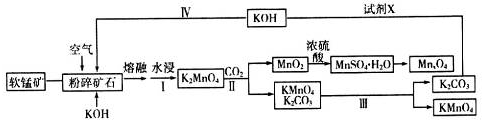
请回答下列问题:
(1)K2MnO4中锰元素的化合价是+6.
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(3)分析下表数据.工业上采用Ⅲ得到较纯净的高锰酸钾,Ⅲ中包含的操作名称是蒸发结晶、过滤、洗涤、干燥.
(4)上述工业流程中试剂X的最佳物质是(填化学式)Ca(OH)2(或CaO);设计步骤Ⅳ的目的是循环利用二氧化锰、氢氧化钾,提高原料利用率.
(5)通过煅烧MnSO4•H2O可制得软磁铁氧体材料MnxO4.下图是煅烧MnSO4•H2O时温度与剩余固体质量变化的曲线.该曲线中A段所表示物质的化学式是MnSO4;MnxO4中x=3.


请回答下列问题:
(1)K2MnO4中锰元素的化合价是+6.
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(3)分析下表数据.工业上采用Ⅲ得到较纯净的高锰酸钾,Ⅲ中包含的操作名称是蒸发结晶、过滤、洗涤、干燥.
| 温度/℃ 溶解度/g | 10 | 20 | 30 | 40 | 60 |
| KC2O3 | 107 | 109 | 111 | 114 | 126 |
| KMnO4 | 2.83 | 4.31 | 6.34 | 9.03 | 12.6 |
(5)通过煅烧MnSO4•H2O可制得软磁铁氧体材料MnxO4.下图是煅烧MnSO4•H2O时温度与剩余固体质量变化的曲线.该曲线中A段所表示物质的化学式是MnSO4;MnxO4中x=3.

9.在无色透明的溶液中,由水电离出C(OH-)=10-12 mol•L-1,下列可能大量共存的离子组 是( )
| A. | Ba2+、NH4+、Cl-、AlO2- | B. | Na+、NO3-、SO42-、I- | ||
| C. | Na+、HCO3-、Cl-、SO4 2- | D. | Fe3+、K+、Cl-、NO3- |
3.关于氮的变化关系图如图:

则下列说法不正确的是( )

则下列说法不正确的是( )
| A. | 路线①②③是工业生产硝酸的主要途径 | |
| B. | 路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 | |
| C. | 上述所有反应都是氧化还原反应 | |
| D. | 上述反应中只有③属于氮的固定 |

 某同学做如图实验,以检验反应中的能量变化.
某同学做如图实验,以检验反应中的能量变化.