题目内容
【题目】NA为阿伏伽德罗常数的值。关于常温下pH=2的H2SO4溶液,溶液中不存在H2SO4分子,但存在HSO4一离子,下列说法错误的是
A.每升溶液中的H+数目为0.01NA
B.Na2SO4溶液中:c(Na+)=2c(SO42-)>c(H+)=2c(OH-)
C.向稀硫酸中逐滴滴加浓硫酸,溶液中![]() 减小
减小
D.NaHSO4不是弱电解质
【答案】B
【解析】
常温下![]() 的
的![]() 溶液,溶液中不存在
溶液,溶液中不存在![]() 分子,但存在
分子,但存在![]() 离子,说明硫酸的第一步完全电离,第二步部分电离。
离子,说明硫酸的第一步完全电离,第二步部分电离。
A. 由![]() 可得
可得![]() ,每升溶液中的
,每升溶液中的![]() 数目为
数目为![]() ,故A正确;
,故A正确;
B. ![]() ,硫酸根有一部分水解成硫酸氢根,c(Na+)>2c(SO42-),根据电荷守恒式可知,c(OH-) >c(H+),所以应该为c(Na+)>2c(SO42-)>c(OH-) >c(H+),故B错误;
,硫酸根有一部分水解成硫酸氢根,c(Na+)>2c(SO42-),根据电荷守恒式可知,c(OH-) >c(H+),所以应该为c(Na+)>2c(SO42-)>c(OH-) >c(H+),故B错误;
C.据已知可知![]() ,当向稀硫酸中逐滴滴加浓硫酸
,当向稀硫酸中逐滴滴加浓硫酸![]() 会增大,所以
会增大,所以![]() 减小,故C正确;
减小,故C正确;
D. NaHSO4属于盐,完全电离,故不是弱电解质,D正确;
故答案为:B。

【题目】某兴趣小组运用如图所示组合装置(部分夹持装置未画出)进行探究实验。
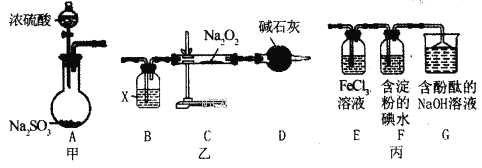
请回答下列问题:
(1)A同学将甲、乙装置组合进行实验,其实验目的是探究__反应的生成物;在连接好装置后,首先要进行的实验操作为___。
(2)为检验C装置中反应生成物是否有氧气,装置B中盛放的试剂X应为__,装置D中碱石灰的作用是__;
(3)B同学将甲、丙装置组合进行实验,能说明I-的还原性弱于SO2的现象为__,发生反应的离子方程式是__。
(4)装置G中的现象是__,说明SO2具有__性。
(5)为验证装置E中SO2与FeCl3发生了氧化还原反应,C同学设计了两套方案,完成下表:
实验操作 | 实验现象 | 实验结论 | |
方案1 | 取少量装置E中的溶液于试管中,向其中滴加___溶液 | 产生白色沉淀 | SO2与FeCl3发生了氧化还原反应 |
方案2 | 取少量装置E中的溶液于试管中,向其中滴加___溶液 | ___ |


