题目内容
【题目】对可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O)
【答案】D
【解析】
试题A、化学反应中反应速率之比等于化学计量数之比,根据化学方程式可知4v正(O2)=5v正(NO)故A错误;B、若单位时间内生成xmolNO的同时,消耗xmolNH3,则只表明反应正向进行,不能体现正逆反应速率相等,故B不正确;
C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小,故C错误;
D、化学反应中反应速率之比等于化学计量数之比,根据化学方程式可知3v正(NH3)=2v正(H2O)在平衡状态和反应过程中都成立,说明反应达到平衡状态,

【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离 子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A. 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
B. 滤液M中存在Mg2+,不存在Ca2+
C. 滤液N中存在Mg2+、Ca2+
D. 沉淀物X为CaCO3
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握______________的活塞,右手摇动___________,眼睛注视________________,直到加入最后一滴盐酸时,溶液由______色变为______色,并_____________________为止。
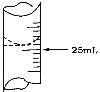
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为____________。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000 mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数

