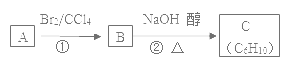题目内容
【题目】硼、镁及其化合物在工农业生产中应用广泛。
Ⅰ.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:
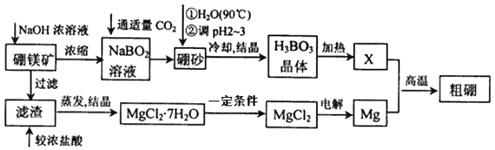
(1)写出硼元素在周期表中的位置___。
(2)将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取硼酸H3BO3,该反应的离子方秳式为___。
(3)由MgCl27H2O制备MgCl2时,一定条件是___。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.2000g粗硼制成的BI3完全分解,将生成的I2配制成100mL溶液,用酸式滴定管量取10mL碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用0.3000molL-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00mL。(提示:I2+2S2O32-=2I-+S4O6)滴定终点的现象为___,该粗硼样品的纯度为___%。
Ⅱ(5)已知:H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1mol/LNa2CO3溶液,__(填“能”或“不能”)观察到气泡逸出。
(6)H3BO3[也可写成B(OH)3]可以通过电解NaB(OH)4溶液的方法制备。工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)。
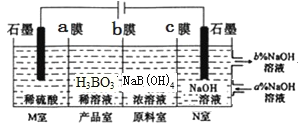
①b膜为__交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式:___理论上每生成1molH3BO3,阴极室可生成___L气体(标准状况)。
②N室中,进口和出口的溶液浓度大小关系为a%___b%(填“>”戒“<”)。
【答案】第二周期第ⅢA族 B4O72-+2H++5H2O=4H3BO3 在HCl氛围中加热 当滴入最后一滴Na2S2O3溶液时,溶液恰好由蓝色褪至无色,且半分钟不褪色 99% 不能 阴离子 H++[B(OH)4]-=H3BO3+H2O 11.2 <
【解析】
硼镁矿主要成分为Mg2B2O5H2O,硼镁矿加入氢氧化钠浓溶液,过滤得到滤渣为氢氧化镁,滤渣中加入浓盐酸得氯化镁溶液,通过蒸发浓缩得到氯化镁结晶水合物,为防止氯化镁水解,在氯化氢气流中加热得到氯化镁固体,电解熔融的氯化镁得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂Na2B4O710H2O,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,加热得到B2O3;Mg与B2O3发生置换反应得到粗硼。
(1)B元素的原子序数为5,位于元素周期表中第二周期第ⅢA族;
(2)用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3,反应的离子方程式为B4O72-+2H++5H2O=4H3BO3;
(3)加热MgCl27H2O时,氯化镁水解生成氢氧化镁,在HCl氛围中加热可以抑制MgCl2的水解,由MgCl27H2O制备MgCl2时,一定条件是在HCl氛围中加热;
(4)将0.2000g粗硼制成的BI3完全分解,生成的I2用0.30molL-1Na2S2O3溶液滴定至终点,并选用淀粉作指示剂,达到滴定终点的现象为:当滴入最后一滴标准液时,溶液恰好由蓝色褪至无色,且半分钟不回复原色;消耗硫代硫酸钠的物质的量为:0.3000mol/L×0.018L=0.0054mol,根据关系式B~BI3~![]() I2~3S2O32-可知:n(B)=
I2~3S2O32-可知:n(B)=![]() n(S2O32-)=0.0054mol×
n(S2O32-)=0.0054mol×![]() =0.0018mol,硼的质量为:11g/mol×0.0018mol=0.0198g,则粗硼中硼的含量为:
=0.0018mol,硼的质量为:11g/mol×0.0018mol=0.0198g,则粗硼中硼的含量为:![]() ×100%=99%;
×100%=99%;
(5)H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7,因5.8×10-10<4.4×10-7,酸性H3BO3< H2CO3,所以不能观察到气泡逸出;
(6)①原料室中的[B(OH)4]-通过b膜进入产品室,M室中氢离子通入a膜进入产品室,则b膜为阴离子交换膜、a膜为阳离子交换膜;产品室发生反应为:H++[B(OH)4]-=H3BO3+H2O; M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,根据得失电子守恒,理论上每生成1mol产品H3BO3,M室生成1molH+、N室生成0.5molH2,阴极生成的气体在标况下的体积:22.4L/mol×0.5mol=11.2L;
②N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大,所以N室中:a%<b%。