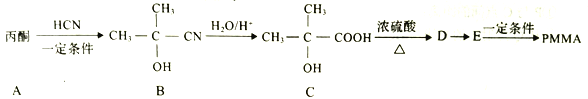
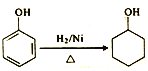
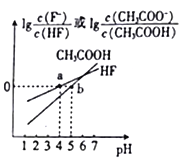
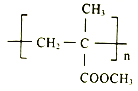题目内容
【题目】辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。
I.已知: ①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ.mol-1
②Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4kJ.mol-1
(1)Cu2S与Cu2O反应生成Cu和SO2的热化学方程式为_____________。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) △H2
CH3OH(g)+C2H5OH(g) △H2
(2)压强为pkPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图1所示,则△H1____(填“>”或“<”,下同)0、△H2_____0。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示。在300~600K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。

(3)若压强为pkPa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为_________,该条件下平衡常数K=_____________。
(4)以铜为原料,利用电解法可制取具有广泛用途的光电材料——纳米Cu2O,其工作原理如图3所示。则b是_______极,电解时阳极的电极反应式为______________。

【答案】 2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0kJ/mol < < 300~600K范围内,随着温度升高,反应①对应的平衡体系向逆反应方向移动的程度比反应②的小 0.225mol·L-l·min-1 180 负 2Cu+2OH--2e-=Cu2O+H2O
【解析】(1)Cu2S与Cu2O反应生成Cu和SO2的化学方程式为Cu2S+2Cu2O=6Cu+SO2↑。由②×3-①,可得2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0kJ/mol。
(2)由图1可知,压强相同,温度升高,二甲醚和乙酸甲酯的平衡转化率均减小,则△H1和△H2都小于0,即△H1<0,△H2<0。温度升高,反应①和反应②均逆向移动,但反应②受温度影响更大,逆向移动程度大,导致乙酸甲酯的百分含量增大,乙醇的百分含量逐渐减小。
故答案为:<;< ;300~600K范围内,随着温度升高,反应①对应的平衡体系向逆反应方向移动的程度比反应②的小。
(3)由图1可知,压强为pkPa、温度为800K时,CH3OCH3的平衡转化率为0.9,根据已知条件,列出反应①的三段式:
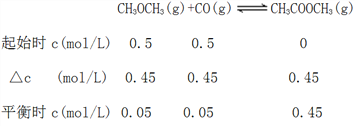
v(CH3COOCH3)=0.45mol/L÷2min=0.225mol·L-l·min-1;
K=![]() =180.
=180.
故答案为:0.225mol·L-l·min-1;180.
(4)电化学法制备Cu2O时,Cu失电子生成Cu2O,则Cu应为阳极,Fe为阴极。Fe接电源负极,则b为负极。电解时,阳极电极反应为2Cu+2OH--2e-=Cu2O+H2O。
故答案为:负;2Cu+2OH--2e-=Cu2O+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】请用图中所示实验装置证明氧化铜能加快约7%的双氧水的分解并与二氧化锰的催化效果进行比较(即比较反应速率)。用图示装置测量产生气体的体积,其他可能影响实验的因素均已忽略,相关数据如下:
实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
① | 15mL | 无 | |
② | 15mL | CuO(0.5g) | |
③ | 15mL | MnO2(0.5g) |
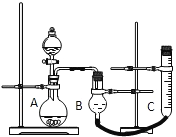
(1)从实验原理来看,实验中的“待测数据”可以指___________,也可以指___________。
(2)实验时气体收集在B中,B仪器名称是___________。若要检验产生的气体是O2,待气体收集结束后,用弹簧夹夹住B下端乳胶管,打开单孔橡皮塞,___________。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体步骤):a.证明CuO的化学性质没有变化,b.______________。
(4)实验开始时,当往容器中加入一定量的双氧水后,由于短时间内产生大量气体,分液漏斗内的液体不能顺利流下,为了解决这个问题,你采取的措施是______________;在测量生成的气体体积时,除了要注意视线与凹液面相平以外,还应注意__________。