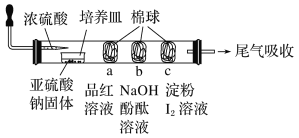
题目内容
【题目】把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入过量氯水,再加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到固体残渣。上述沉淀和残渣分别为
A. Fe(OH)2 ;Fe2O3 B. Fe(OH)2;FeO
C. Fe(OH)2、Fe(OH)3;Fe2O3 D. Fe(OH)3;Fe2O3
【答案】D
【解析】把少量废铁屑溶于过量稀硫酸中反应生成硫酸亚铁,过滤,除去杂质,在硫酸亚铁中加入过量氯水,亚铁离子被氧化生成铁质量,再加入过量的氨水,有氢氧化铁沉淀生成,过滤,加热沉淀物至质量不再发生变化,得到的固体残渣为Fe2O3,故选D。

练习册系列答案
相关题目
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
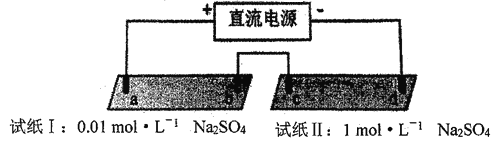
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快