题目内容
【题目】某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱。
[提出假设] 假设1:Fe2+还原性比I-强。
假设2:I-还原性比Fe2+强。
[验证假设] 选择几种装置进行实验:
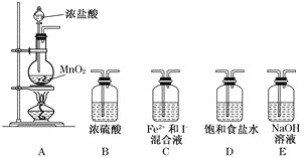
(1)实验必需的装置是A→____________(按Cl2气流方向的顺序填写)。
(2)实验开始后,控制通入氯气的量,当通入少量氯气时,通过观察混合溶液颜色的变化________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论________、________、________、________、_______、________。

(4)为了实验成功,必须控制各物质的量。该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液。为了验证上述假设,通入的Cl2体积最多不能超过________L(标准状况)。
[思考与交流]
(5)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序。于是提出另一方案:往KI溶液中滴入________溶液,如果能发生反应,即可证明I-的还原性强于Fe2+。
【答案】C→E 不能KSCN溶液淀粉溶液变红色不变色不变色变蓝色0.112FeCl3
【解析】
(1)Cl2中的水蒸气、HCl不影响Cl2与Fe2+、I-的反应,故不必除去,但尾气要进行处理,故必需的装置是A→C→E;
(2)因为Fe2+、I-被Cl2氧化后生成的Fe3+、I2溶液均显黄色,故不能判断反应的先后顺序;
(3)检验Fe3+一般选用KSCN溶液,检验I2一般选用淀粉溶液。然后根据A、B试管中的颜色变化判断假设1、2的正确性;
(4)1.52 g FeSO4固体的物质的量为0.01 mol,1.66 g KI固体的物质的量也是0.01 mol,与Cl2的反应分别为:2Fe2++Cl2=2Fe3++2Cl-,2I-+Cl2=I2+2Cl-,故通入的氯气的物质的量不能超过0.005 mol,即0.112 L(标准状况);
(5)可直接利用2Fe3++2I-=I2+2Fe2+,判断I-与Fe2+的还原性强弱。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
