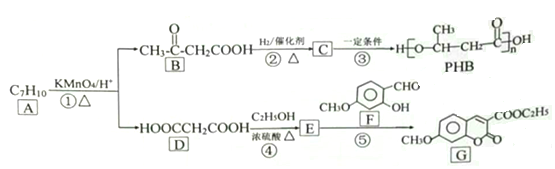
题目内容
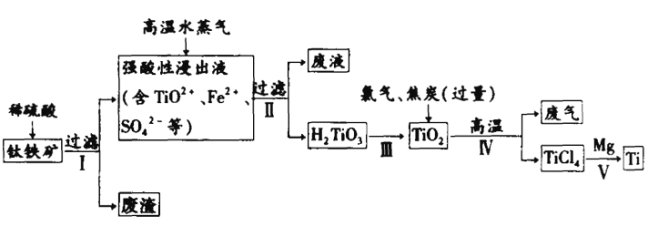
【题目】金属钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸浸钛铁矿(其主要成分为钛酸亚铁(FeTiO 3它难溶于水,但能与酸反应)的方法制取二氧化钛 ,再由二氧化钛 制取金属钛。工艺流程如下:
回答下列问题
(1) FeTiO3中钛元素的化合价为____。
(2)稀硫酸与FeTiO3反应的离子方程式为:____。
(3)过程V表现了金属镁的还原性比金属钛的还原性____(填“强”或“弱”)。
(4)写出过程IV的化学方程式____(注意焦炭过量)。
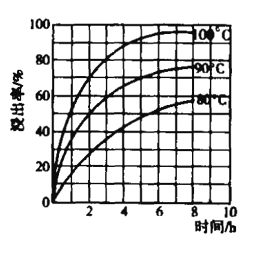
(5)酸浸中,铁的浸出率与时间、温度的关系如图所示,如图可知,当铁的浸出率为70%时,可采用的实验条件为____。
【答案】+4 FeTiO3 + 4 H+ =Fe2+ +TiO2+ +2H2O 强 TiO2 +2 Cl2 + C![]() TiCl4 +2CO 100摄氏度2h 或 90摄氏度 5h
TiCl4 +2CO 100摄氏度2h 或 90摄氏度 5h
【解析】
(1)根据化合物中正负价代数和为0解答;
(2)根据流程图中元素的存在形式判断生成物;
(3)根据活泼的金属能置换出不活泼的金属判断;
(4)TiO2与氯气、焦炭在高温下反应生成四氯化钛、CO,据此书写;
(5)根据图像结合浸出率判断需要的温度和时间。
(1)FeTiO3中Fe是+2价,O是-2价,所以根据化合物中正负价代数和为0钛元素的化合价为+4价。
(2)根据流程图可知加入稀硫酸后有亚铁离子和TiO2+生成,则稀硫酸与FeTiO3反应的离子方程式为FeTiO3+4H+=Fe2++TiO2++2H2O。
(3)过程V中金属镁和四氯化钛发生置换反应生成金属Ti和氯化镁,则表现了金属镁的还原性比金属钛的还原性强。
(4)过程IV中焦炭过量,则碳转化为CO,所以反应的化学方程式为TiO2+2Cl2+C![]() TiCl4+2CO。
TiCl4+2CO。
(5)由图可知,当铁的浸出率为70%时,所采用的实验条件为选择温度为100℃、2h或90℃、5h。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】下列除去杂质的方法中错误的是( )
物质 | 杂质 | 除杂质的方法 | |
A | SiO2 | CaCO3 | 过量稀硫酸、过滤 |
B | 铜粉 | 铝粉 | 过量CuCl2溶液、过滤 |
C | FeCl3溶液 | FeCl2 | 通入适量氯气 |
D | SO2 | HC1 | 通过NaHSO3溶液的洗气瓶 |
A. A B. B C. C D. D