题目内容
【题目】CH4和H2O在一定条件下, 可以转化为合成一系列有机化合物、氨的重要原料(CO+H2),这种方法称作甲烷水蒸气重整法制合成气,其能量变化如图:

(1)甲烷水蒸气重整法制合成气的热化学方程式为_______;该反应只有在_____(填“高温”、“低温”或“常温”)才自发进行。
(2)下列有关甲烷水然气重整法制合成气的说法正确的是_____(填字母)。
A.相同条件下,该反应的逆反应更易发生
B.恒温恒容时充入一定量CO2,可促进CH4转化并可调节CO和H2的比例
C.若反应的高效催化剂为A,则A一定是CO和H2合成CH4的高效催化剂
D.恒温时向上述平衡体系中充入少量Ar,平衡一定不移动
E.有副反应:H2O+CO![]() CO2+H2
CO2+H2
(3)在恒容密闭容器中充入2mol的CH4和H2O(g)混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图所示。请问a、b两点比较(填“>”、“<”、“=”);CH4的转化率a点____b点,a点CH4的浓度_____b点H2O(g)的浓度,氢气的产率a点_____b点。

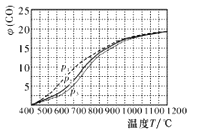
(4)当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图,则压强由大到小的排序是_____;当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是_____________________。
(5)在下图左室充入1molCH4和H2O(g)混合气体(物质的量之比为1:1),恒温条件下反应建立平衡,测得CH4的转化率为50%,则其平衡常数为_________ 。

【答案】 CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.1 kJ/mol 高温 ABCE > = = p3>p2>p1 当T<450℃时,几乎不反应,所以压强的改变对φ(CO) 几乎无影响;当T≥1000℃时,φ(CO)已经很大,甲烷的转化率已经达到了90%以上,所以压强的改变对φ(CO)影响很小。 0.75
【解析】(1)本题考查热化学反应方程式的书写,以及反应反应方向的进行,根据能量变化图,热反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g) △H=(240.1-34.0)kJ·mol-1=+206.1kJ·mol-1;根据△G=△H-T△S,此反应是吸热反应,即△H<0,此反应是熵增,即△S>0,因此能自发进行,△G<0,即在高温下;(2)本题考查影响化学反应速率的因素,A、根据图像,逆反应的活化能小,因此逆反应更易发生,故A正确;B、反应体系中存在CO+H2O ![]() CO2+H2反应,恒温恒容时充入一定量的CO2,可促进产物中H2反应,提高CH4的平衡转化率,并适当减少H2的物质的量,增加CO的物质的量,调节CO和H2的比例,故B正确;C、使用催化剂降低反应的活化能,某可逆反应的正反应使用催化剂一定也是逆反应的催化剂,故C正确;D、恒温恒容时充入非反应气体,组分的浓度不变,平衡不移动,如果是恒温恒压下,充入非反应气体,组分的浓度降低,平衡正向移动,故D错误;E、反应体系中存在CO+H2O
CO2+H2反应,恒温恒容时充入一定量的CO2,可促进产物中H2反应,提高CH4的平衡转化率,并适当减少H2的物质的量,增加CO的物质的量,调节CO和H2的比例,故B正确;C、使用催化剂降低反应的活化能,某可逆反应的正反应使用催化剂一定也是逆反应的催化剂,故C正确;D、恒温恒容时充入非反应气体,组分的浓度不变,平衡不移动,如果是恒温恒压下,充入非反应气体,组分的浓度降低,平衡正向移动,故D错误;E、反应体系中存在CO+H2O ![]() CO2+H2反应,故E正确;(3)本题是影响化学平衡移动的因素以及化学平衡的计算,x越大,甲烷的量越多,因此甲烷的转化率降低,即a点甲烷的转化率大于b点甲烷转化率;当比值为9:11,设甲烷为9mol,H2O为11mol, CH4(g)+H2O(g)=CO(g)+3H2(g)
CO2+H2反应,故E正确;(3)本题是影响化学平衡移动的因素以及化学平衡的计算,x越大,甲烷的量越多,因此甲烷的转化率降低,即a点甲烷的转化率大于b点甲烷转化率;当比值为9:11,设甲烷为9mol,H2O为11mol, CH4(g)+H2O(g)=CO(g)+3H2(g)
起始:9 11 0 0
变化:x x x 3x
平衡:9-x 11-x x 3x 氢气的体积分数为3x/(20+2x) 当比值为11:9,设甲烷为11mol,H2O为9mol,
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始:11 9 0 0
变化:y y y 3y
平衡:11-y 9-y y 3y 氢气的体积分数为3y/(20+2y),因为在a点和b点,氢气的体积分数相等,即推出x=y,a点甲烷的浓度等于b点水蒸气的浓度;两点的氢气产率相等;(4)考查影响化学平衡移动的因素,相同温度下增大压强,平衡向逆反应方向移动,CO的体积分数减小,则压强p3>p2>p1;当T<450℃时,几乎不反应,所以压强的改变对φ(CO) 几乎无影响;当T≥1000℃时,φ(CO)已经很大,甲烷的转化率已经达到了90%以上,所以压强的改变对φ(CO)影响很小;(5)考查化学平衡常数的计算CH4(g)+H2O(g)=CO(g)+3H2(g)
起始:0.5 0.5 0 0
变化:0.25 0.25 0.25 0.75
平衡:0.25 0.25 0.25 0.75 等温等压下,体积之比等于物质的量之比,达到平衡后,容器的体积为1.5L,根据平衡常数的定义,K=c3(H2)×c(CO)/[C(CH4)×c(H2O)],代入数值,解得K=0.75。

【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
![]()
经一段时间后达到平衡,反应过程中测定的部分数据如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/ mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A. 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0%
B. 反应在前20分钟的平均速率为v(H2)=0.008molmol/( L min)
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品。
(2)将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要____________________。
(3)取10.00mL待测液,用___________________ 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视____________,至出现______________的现象时即到达滴定终点。
(5)根据下列数据,计算待测烧碱的纯度:__________________。(保留四位有效数字)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(6)以下操作会造成测量结果偏高的是(_________)
①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管;
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)
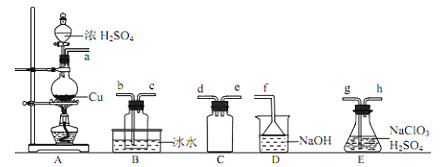
①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
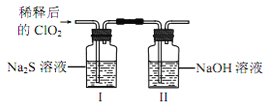
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。