题目内容
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品。
(2)将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要____________________。
(3)取10.00mL待测液,用___________________ 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视____________,至出现______________的现象时即到达滴定终点。
(5)根据下列数据,计算待测烧碱的纯度:__________________。(保留四位有效数字)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(6)以下操作会造成测量结果偏高的是(_________)
①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管;
【答案】 250 mL容量瓶、胶头滴管 碱式滴定管(移液管也可) 锥形瓶中溶液颜色的变化 溶液由黄色变为橙色,且半分钟内不恢复 98.05% ②④
【解析】(1)准确称取4.1g烧碱样品。
(2)将样品配成250mL待测液要用到250 mL容量瓶,还需要用胶头滴管定容。
(3)滴定管和移液管的精确度可达到0.01mL,取10.00mL待测液,因为溶液呈碱性,所以可以用碱式滴定管(或移液管)量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化 ,由于甲基橙的变色范围是3.1~4.4,pH大于4.4时溶液呈黄色,在突变范围内是橙色,所以当溶液由黄色变为橙色,且半分钟内不变色的现象时即到达滴定终点。
(5)根据表中数据,先求出每次滴定所耗标准液的体积分别为19.90、22.00、20.10,显然第二次滴定的误差较大应舍去不用,算出另外两次的平均值为20.00mL,然后计算待测烧碱的纯度=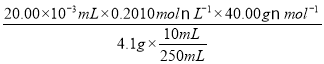 =98.05%。
=98.05%。
(6)①用蒸馏水冲洗锥形瓶对滴定结果无影响;②在滴定过程中不慎将数滴酸液滴在锥形瓶外,这些盐酸没与碱反应,导致标准液用量偏大,使测定结果偏高;③因为0刻度在上,读数时,滴定前仰视,使初读数变大,滴定后俯视,使末读数变小,这样计算出耗酸量偏少了,所以测定结果偏低;④装标准液之前,没有用标准液润洗滴定管,标准液会被残留的蒸馏水稀释,滴定时所用盐酸的体积必然偏大,所以结果偏高。综上所述会造成测量结果偏高的是②④。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】分类法是一种行之有效、简单易行的科学方法。某同学用下表所示对所学知识进行分类,其中甲与乙、丙、丁是包含关系。下列各组中,正确的组合是
选项 | 甲 | 乙、丙、丁 |
A | 纯净物 | 液氯、KAl(SO4)2、CuSO4·5H2O |
B | 能导电 | Fe、NaCl晶体、AgCl |
C | 碱 | 一水合氨、NaOH、纯碱 |
D | 电解质 | 盐酸、硫酸、硝酸 |
A. A B. B C. C D. D