题目内容
【题目】NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1molL-1NH4Al(SO4)2溶液的pH=3。
①溶液的Kw=______(填数值),由水电离的c(H+)=_____molL-1。
②溶液中c(NH4+)+c(NH3H2O)_____c(Al3+)+c(Al(OH)3)(填>”“=”“<”);
2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=_______molL-1(计算式);
(2)80℃时,0.1molL-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是______;
(3)常温时,向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。
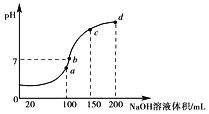
①图中a、b、c、d四个点中水的电离程度最小的是______。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为______。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是_____。
(4)NH4Al(SO4)2可做净水剂,写出工业制金属铝的化学方程式______;
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为______;每消耗3.4gNH3转移电子的物质的量为______。

【答案】1.0×10-14 1.0×10-3 = 10-3﹣10-11 NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小 d H++OH-=H2O c(H+)>c(SO42-)>c(NH4+)>c(OH-) 2Al2O3![]() 4Al+3O2↑ 2NH3+6OH--6e-=N2+6H2O 0.6mol
4Al+3O2↑ 2NH3+6OH--6e-=N2+6H2O 0.6mol
【解析】
(1)①常温时,水的离子积常数为1.0×10-14;0.1molL-1![]() 溶液的pH=3是因为铵根离子和铝离子的水解;
溶液的pH=3是因为铵根离子和铝离子的水解;
②据物料守恒分析;根据电荷守恒计算;
(2)![]() 水解,升高温度其水解程度增大;
水解,升高温度其水解程度增大;
(3)①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完![]() ,溶液中只有
,溶液中只有![]() 与
与![]() ;b、c、d三点溶液均含有
;b、c、d三点溶液均含有![]() ,
,![]() 可以促进水的电离,而
可以促进水的电离,而![]() 抑制水的电离,b点溶液呈中性;
抑制水的电离,b点溶液呈中性;
②向100mL 0.1molL-1![]() 溶液中滴加0.1molL-1
溶液中滴加0.1molL-1![]() 溶液100mL时,仅发生氢离子和氢氧根离子的中和反应;
溶液100mL时,仅发生氢离子和氢氧根离子的中和反应;
(4)工业上通过电解熔融的氧化铝制金属铝;
(5)根据电子运动方向,判断a为负极,写出电极反应式并计算转移电子数。
(1)①常温时,水的离子积常数为l.0×l014;0.1molL1![]() 溶液的pH=3是因为铵根离子和铝离子的水解,所以由水电离的
溶液的pH=3是因为铵根离子和铝离子的水解,所以由水电离的![]() ,
,
故答案为:1.0×10-14;1.0×10-3;
②据物料守恒,![]() 中
中![]() 原子与
原子与![]() 原子个数比为1:1,所以
原子个数比为1:1,所以![]() ;根据电荷守恒得
;根据电荷守恒得![]()
故答案为:=;1031011;
(2) ![]() 水解,升高温度其水解程度增大,pH减小,
水解,升高温度其水解程度增大,pH减小,
故答案为:![]() 水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
(3)①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完![]() ,溶液中只有
,溶液中只有![]() 与
与![]() ;b、c、d三点溶液均含有
;b、c、d三点溶液均含有![]() ,
,![]() 可以促进水的电离,而
可以促进水的电离,而![]() 抑制水的电离,所以d点水的电离程度最小,故答案为:d;
抑制水的电离,所以d点水的电离程度最小,故答案为:d;
②向100mL 0.1molL-1![]() 溶液中滴加0.1molL-1
溶液中滴加0.1molL-1![]() 溶液100mL时,仅发生氢离子和氢氧根离子的中和反应,离子方程式为
溶液100mL时,仅发生氢离子和氢氧根离子的中和反应,离子方程式为![]() ,
,
故答案为:![]() ;
;
③![]() 的电离方程式为
的电离方程式为![]() ,还有水的微弱电离,铵根离子因水解导致浓度略有减小,所以离子浓度由大到小的顺序为
,还有水的微弱电离,铵根离子因水解导致浓度略有减小,所以离子浓度由大到小的顺序为![]() ,故答案为:
,故答案为:![]() ;
;
(4)工业上通过电解熔融的氧化铝制金属铝,方程式为:![]() ,
,
故答案为:![]() ;
;
(5)根据电子运动方向,判断a为负极,氨气发生氧化反应生成氮气,电极反应式为:![]() ;根据电极反应式,2个氨气转移6个电子,故3.4g氨气即0.2mol氨气,转移0.6mol电子,
;根据电极反应式,2个氨气转移6个电子,故3.4g氨气即0.2mol氨气,转移0.6mol电子,
答案为:![]() ;0.6mol。
;0.6mol。

【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
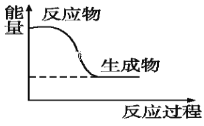
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
【题目】下列实验操作对应的现象与结论均正确的是( )
实验操作 | 现象 | 结论 | |
A | 常温下将 | 烧杯壁变凉 |
|
B | 向两支分别盛有 | 两支试管都有气泡产生 | 醋酸和硼酸的酸性比碳酸强 |
C | 将 | pH减小 | 稀释后 |
D | 常温下向物质的量浓度均为 | 先出现黄色沉淀 |
|
A.AB.BC.CD.D