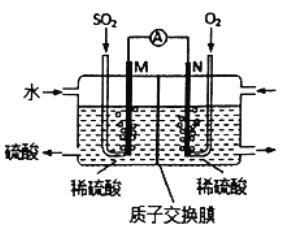
��Ŀ����
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������������ͬ��c������������Ϊ���ڲ��������3����b3-��C2-��������Ų���ͬ�� d��cͬ�壻e�������ֻ��1�����ӣ������ȫ����������˵���������
A. a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪsp3
B. b��c��d�е縺��������d
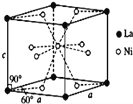
C. e�ļ۲�����Ų�ͼΪ![]()
D. ��5��Ԫ���γɵ�һ��1:1�����ӻ������У������ӳ�������ṹ���þ���ṹ�е������������Ӽ������Լ�����λ��
���𰸡�B
�����������ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e,ԭ��������������,a�ĺ����������������������ͬ,��a��HԪ����c������������Ϊ���ڲ��������3��,ԭ��ֻ����2�����Ӳ�,����������Ϊ6,��c��OԪ����d��cͬ��,��d��SԪ����b3-��c2-��������Ų���ͬ������bΪNԪ����e�������ֻ��1�����ӣ������ȫ������ֻ�ܴ��ڵ�������,���������Ϊ2+8+18+1=29,ΪCuԪ������ԭ���뵪ԭ���γɰ�����������ԭ������sp3�ӻ������ӳ������Σ�A��ȷ��b��c��d�ֱ�ΪN��O��S��ͬһ���ڣ������ң��縺������ͬһ���壬���ϵ��£��縺����С���������Ԫ���е縺��������c��B������eΪͭԪ�����˵����Ϊ29����������Ų�Ϊ1s22s22p63s23p63d104s1���۲�����Ų�ͼΪ![]() ��C��ȷ����5��Ԫ���γɵ�һ��1:1�����ӻ�������,�����ӳ�������ṹ,˵���������Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷ�,ӦΪSO42-����ѧʽΪ
��C��ȷ����5��Ԫ���γɵ�һ��1:1�����ӻ�������,�����ӳ�������ṹ,˵���������Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷ�,ӦΪSO42-����ѧʽΪ![]() ,�þ���ṹ�е������������Ӽ������Լ�����λ���� D��ȷ����ȷѡ��B��
,�þ���ṹ�е������������Ӽ������Լ�����λ���� D��ȷ����ȷѡ��B��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�