题目内容
【题目】用原电池原理可以处理硫酸工业产生的SO2尾气。现将SO2 通入如图装置(电极均为惰性材料)进行实验。下列说法不正确的是
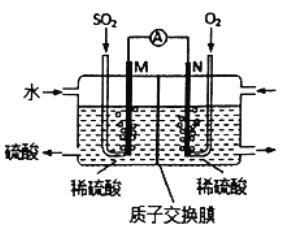
A. M极为负极,电极上发生氧化反应
B. 溶液中H+移向N区,SO42-移向M区
C. N极发生的电极反应为O2+4H++4e-=2H2O
D. 相同条件下,M、N两极上消耗的气体体积之比为2:1
【答案】B
【解析】该电池的本质是二氧化硫、氧气与水反应生成硫酸,M电极上二氧化硫失去电子氧化生成SO42-为负极,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,N电极为氧气得电子结合氢离子生成水为正极,电极反应式为:O2+4H++4e -═2H2O。A.M电极上二氧化硫失去电子氧化生成SO42-为负极,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,故A正确;B.根据上述分析,M极为负极,溶液中的阳离子向正极移动,阴离子向负极移动,但阴离子不能通过质子交换膜,因此溶液中H+移向N区,故B错误;C.N电极为氧气得电子结合氢离子生成水为正极,电极反应式为:O2+4H++4e -═2H2O,故C正确;D.M电极电极反应式为:SO2+2H2O-2e -═SO42-+4H+,N电极电极反应式为:O2+4H++4e -═2H2O,所以在相同条件下,M、N两极上消耗的气体体积之比为2:1,故D正确;故选B。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目