题目内容
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为______________。
②Fe的基态原子共有_________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4═2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为_____________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10﹣2 nm和7.8×10﹣2 nm.则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
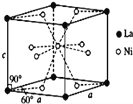
①该晶体的化学式为_____________。
②已知该晶胞的摩尔质量为M gmol﹣1,密度为d gcm﹣3.设NA为阿伏加德罗常数的值,则该晶胞的体积是_____ (用含M、d、NA的代数式表示)。
【答案】 3d24s2 7 O>Cl>C 3:1 sp2 > LaNi5 ![]() cm3
cm3
【解析】(1)考查电子排布式的书写,Ti属于过渡元素,价电子包括最外层电子和次外层d能级上的电子,即Ti的价电子排布式为3d24s2 ;铁元素属于26号元素,电子排布式为1s22s22p63s23p63d64s2,共有7种不同能级的电子;(2)考查电负性的规律、化学键数目的判断、杂化类型的判断,①非金属是O、C、Cl,同周期从左向右电负性增大,根据HClO中化合价,推出O的电负性大于Cl,根据CCl4中化合价,Cl的电负性大于C,即电负性由大到小的规律是O>Cl>C,②COCl2所有原子满足8电子稳定结构,即COCl2的结构式为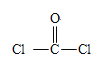 ,成键原子间只能形成一个σ键,双键之间有1个π键,因此σ键和π键数目的比值为3:1;C有3个σ键,无孤电子对,价层电子对数为3,杂化类型为sp2;(3)考查晶体熔沸点高低判断,NiO和FeO都属于离子晶体,根据所给离子半径,Ni2+半径小于Fe2+,NiO的晶格能大于FeO,NiO的熔点高于FeO;(4)考查晶胞的计算,①La位于晶胞的顶点,晶胞实际占有的个数为8×1/8=1,Ni位于面上和内部,晶胞实际占有的个数是8×1/2+1=5,因此化学式为LaNi5;②晶胞的质量为1×M/NAg,根据密度的定义,晶胞的体积为
,成键原子间只能形成一个σ键,双键之间有1个π键,因此σ键和π键数目的比值为3:1;C有3个σ键,无孤电子对,价层电子对数为3,杂化类型为sp2;(3)考查晶体熔沸点高低判断,NiO和FeO都属于离子晶体,根据所给离子半径,Ni2+半径小于Fe2+,NiO的晶格能大于FeO,NiO的熔点高于FeO;(4)考查晶胞的计算,①La位于晶胞的顶点,晶胞实际占有的个数为8×1/8=1,Ni位于面上和内部,晶胞实际占有的个数是8×1/2+1=5,因此化学式为LaNi5;②晶胞的质量为1×M/NAg,根据密度的定义,晶胞的体积为![]() cm3。
cm3。

 习题精选系列答案
习题精选系列答案