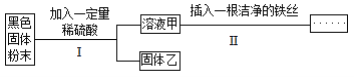
题目内容
【题目】X、Y、Z、 W均为元素周期表中前20号元素,其原子序数依次增大。已知:X与Y可形成原子个数比为1![]() 1的化合物。Z、W简单离子的电子层结构相同。下列说法正确的是
1的化合物。Z、W简单离子的电子层结构相同。下列说法正确的是
A. 若X为IA族时,Y不可能是第三周期VIA族元素
B. 由X、Y、Z、 W四种元素不可能形成其原子个数比为1![]() 1
1![]() 3
3![]() 1的化合物
1的化合物
C. Z元素的离子半径一定小于W元素的离子半径
D. 若X为IVA族元素时,X、Y两元素可形成含有共价键的离子化合物
【答案】D
【解析】A. 若X为IA族时,Y是第三周期VIA族元素,为S元素,二者不能形成XY或X2Y2形化合物,故A错误;B. X与Y可形成原子个数比为1![]() 1的化合物,X与Y可能是C、H。Z、W简单离子的电子层结构相同,可能是O、Na,可能组成原子个数比为1
1的化合物,X与Y可能是C、H。Z、W简单离子的电子层结构相同,可能是O、Na,可能组成原子个数比为1![]() 1
1![]() 3
3![]() 1的化合物为碳酸氢钠,故B错误;C. Z、W简单离子的电子层结构相同,则Z为第2周期的后半段元素,W为第3周期前半段的元素,或Z为第3周期的后半段元素,W为第4周期前半段的元素,根据电子层结构相同的元素,核电荷数越大,离子半径越小, Z元素的离子半径一定大于W元素的离子半径,故C错误;D. 若X为IVA族的碳元素时,Y可能为钠元素,X、Y两元素可形成Na2C2,属于含有共价键的离子化合物,故D正确;故选D。
1的化合物为碳酸氢钠,故B错误;C. Z、W简单离子的电子层结构相同,则Z为第2周期的后半段元素,W为第3周期前半段的元素,或Z为第3周期的后半段元素,W为第4周期前半段的元素,根据电子层结构相同的元素,核电荷数越大,离子半径越小, Z元素的离子半径一定大于W元素的离子半径,故C错误;D. 若X为IVA族的碳元素时,Y可能为钠元素,X、Y两元素可形成Na2C2,属于含有共价键的离子化合物,故D正确;故选D。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目