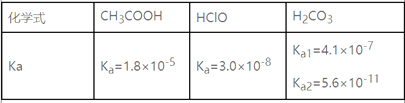
题目内容
【题目】某含铜样品的主要成分为aCuCO3·bCu(OH)2(a、b均为最简正整数),为测定其化学组成和Cu元素的质量分数,甲、乙两个实验小组经查阅资料,设计了两种不同的实验方案(假定杂质对实验无干扰)。
Ⅰ.甲组同学利用以下方法测定:
①在一定质量的样品中加入过量的稀硫酸,过滤,测量产生气体的体积(忽略水蒸气的体积);
②在滤液中加过量的NaOH稀溶液,过滤;
③灼烧②中所得滤渣,直至残留固体恒重。
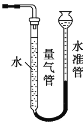
(1)为了除去滤渣中的可溶性杂质,需要对滤渣进行的操作是_______。滤渣应在_________________________(填仪器名称)中进行灼烧。
(2)利用如图装置测量气体体积时,读数时应注意:①恢复至室温;②________;③平视且视线与凹液面最低处相切。若操作无误,但气体体积测量结果仍然明显偏低,合理的改进措施是__________。
(3)甲组同学在处理实验数据时,将常温常压下测得的气体体积V L换算成V/22.4 mol进行计算,则计算所得的a将_______(填“偏大”“偏小”或“无影响”)。
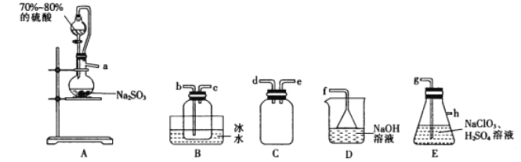
Ⅱ.乙组同学利用如图装置进行测定(夹持及加热装置略去):
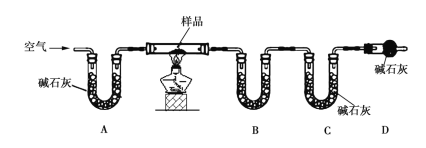
(4)装置B中的药品是_______,装置D的作用是__________________________。
(5)若样品的质量为20 g,充分反应后测得装置B中固体质量增加了0.9 g,装置C中固体质量增加了4.4 g,则样品中主要成分的化学式为__________,样品中铜元素的质量分数为______________________。
【答案】洗涤 坩埚 调节量气管和水准管的液面相平 将量气装置中的水换为饱和碳酸氢钠溶液 偏大 无水氯化钙 防止空气中的水蒸气和二氧化碳进入装置C,影响测定结果 2CuCO3·Cu(OH)2 48%
【解析】
甲组同学的方法:加入过量稀硫酸使碳酸铜和氢氧化铜均溶解,溶解时放出二氧化碳,通过测量气体体积可得碳酸铜的量;在滤液中加入过量的氢氧化钠溶液,首先中和掉上一步过量的酸,然后使Cu2+沉淀,通过称量灼烧后的沉淀的量可以得到Cu2+的量。
乙组同学的方法:将样品反应得到的水和二氧化碳分步吸收,通过仪器质量的变化得到各组分的量。
(1)滤渣上还附着大量的硫酸钠,需要通过洗涤操作洗掉;进行固体灼烧操作应该使用的仪器是坩埚。
(2) 利用如图装置测量气体体积,读数时应注意:①恢复至室温;②调节量气管和水准管的液面相平,使压力相等;③平视且视线与液体的凹液面最低处相切,这样才能得到准确的读数,若操作无误,但气体体积测量结果仍然明显偏低,可能是由于水对二氧化碳的溶解吸收作用,可改为吸收CO2能力更小的饱和碳酸氢钠溶液。
(3)常温常压下测得的气体体积比标准状况下测得的大,可以计算得到的气体的物质的量比实际大,a值将偏大。
(4)B的作用是吸收样品中分解产生的水蒸气,不能将二氧化碳同时吸收,可以选择无水氯化钙;D的作用是防止空气中的水蒸气和二氧化碳进入装置C,影响测定结果。
(5)0.9g水的物质的量为0.05mol,4.4g二氧化碳的物质的量为0.1mol,所以碳酸铜与氢氧化铜的化学计量数之比为2:1,则a=2,b=1,所以化学式为2CuCO3·Cu(OH)2;该样品的物质的量为0.05mol,样品中的铜元素的质量为:0.05mol×3×64g·mol-1=9.6g,其质量分数为9.6g/20g×100%=48%。