题目内容
【题目】已知I、II反应在一定条件节焓变及平衡常数如下:
2H2(g)+S2(g)![]() 2H2S(g)K 1 △H1 (1)
2H2S(g)K 1 △H1 (1)
3H2(g)+SO2(g)![]() 2H2O(g)+H2(g)K2 △H2(2)
2H2O(g)+H2(g)K2 △H2(2)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)![]() S2(g)+4H2O(g)的△H=________。
S2(g)+4H2O(g)的△H=________。
(2)回答下列反应(1)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,l0min时反应达到平衡.此时测得l0min内V(H2S)=0.08molL-1min-l,若此时再向容器中充入H2、S2、H2S各0.8mol,则平衡移动方向为_______(填“正向”、“逆向”或“不移动”);
②温度为T2时(T2>Tl),在1L恒容容器中也加入1.8molH2、1.2molS2,建立平衡时测得S2的转化率为25%,据此判断△H1________0(填“>”或“<”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________(写出主要反应的离子方程式),该溶液中,[Na+]________2[SO32-]+[HSO3-](填“>”、“<”或“=‘’)。
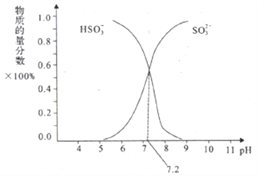
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO32-的水解平衡常数=________molL-1。
【答案】 △H=2△H2-△H1 正向 < SO32-+H2O![]() HSO3-+OH- > 10-6.8
HSO3-+OH- > 10-6.8
【解析】本题主要考查关于平衡常数的计算。
(1)反应2(2)-(1)可得4H2(g)+2SO2(g)![]() S2(g)+4H2O(g) △H=△H=2△H2-△H1。
S2(g)+4H2O(g) △H=△H=2△H2-△H1。
(2)①温度为T1,平衡浓度为:c(H2S)=0.8molL-1,c(H2)=(1.8-0.8)molL-1=1.0molL-1,c(S2)=(1.2-0.4)molL-1=0.8molL-1,平衡常数K1=![]() =0.8,若此时再向容器中充入H2、S2、H2S各0.8mol,各物质浓度为c(H2S)=1.6molL-1,c(H2)=1.8molL-1,c(S2)=1.6molL-1,浓度商Qc=40/81<K=0.8,则平衡移动方向为正向;
=0.8,若此时再向容器中充入H2、S2、H2S各0.8mol,各物质浓度为c(H2S)=1.6molL-1,c(H2)=1.8molL-1,c(S2)=1.6molL-1,浓度商Qc=40/81<K=0.8,则平衡移动方向为正向;
②温度为T1,平衡时S2的转化率为0.4/1.2=1/3>25%,温度为T2时(T2>Tl),平衡常数K减小,表明升温平衡左移,据此判断△H1<0;
(3)①已知Na2SO3水溶液显碱性,原因是SO32-+H2O![]() HSO3-+OH-,该溶液中,[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3],所以[Na+]>2[SO32-]+[HSO3-]。
HSO3-+OH-,该溶液中,[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3],所以[Na+]>2[SO32-]+[HSO3-]。
②SO32-+H2O![]() HSO3-+OH-,SO32-的水解平衡常数Kh=
HSO3-+OH-,SO32-的水解平衡常数Kh= ,当pH=7.2时,c(SO32-)=c(HSO3-),Kh= c(OH-)=
,当pH=7.2时,c(SO32-)=c(HSO3-),Kh= c(OH-)=![]() =
=![]() molL-1=10-6.8molL-1。
molL-1=10-6.8molL-1。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案