题目内容
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
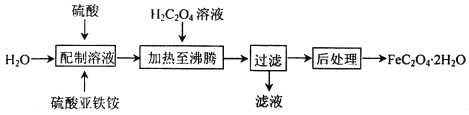
(1)配制硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液时,除需加硫酸外还需要加少量铁屑的目的是________。
(2)加热至沸腾生成沉淀时反应的化学方程式为________________________。
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成.这说明草酸亚铁晶体具有________(填“氧化”或“还原”)性.若反应中消耗1mol FeC2O42H2O,则参加反应的n(KMnO4)为________。
(4)称取3.60g草酸亚铁晶体(摩尔质量是180gmol﹣1)用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
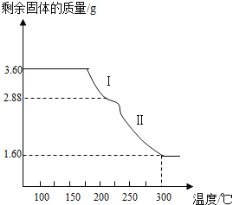
①过程Ⅰ发生反应的化学方程式为________________________。
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式___________(写出计算过程)
【答案】防止Fe2+被氧化 (NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4+(NH4)2SO4 还原 0.6mol FeC2O42H2O![]() FeC2O4+2H2O↑ Fe2O3
FeC2O4+2H2O↑ Fe2O3
【解析】
在稀硫酸溶液中配置硫酸亚铁铵,加入草酸沉淀沉淀亚铁离子生成草酸亚铁,静置倾去上层溶液后处理得到草酸晶体,结合题干中的问题、相关物质的性质和氧化还原反应中电子得失守恒分析解答。
(1)配制(NH4)2Fe(SO4)2溶液时,溶液中亚铁离子水解显酸性,需加少量硫酸的目的是抑制其水解,又因为亚铁离子易被氧化,所以还需要加少量铁屑的目的是防止Fe2+被氧化;
(2)沉淀时发生反应为硫酸亚铁铵溶液中加入草酸反应生成草酸亚铁沉淀、硫酸和硫酸铵,反应的化学方程式依据原子守恒配平写出为(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4+(NH4)2SO4;
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,同时有气体生成,说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,消耗1mol FeC2O42H2O,则参加反应的KMnO4为0.6mol;
(4)①通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为FeC2O42H2O![]() FeC2O4+2H2O↑;
FeC2O4+2H2O↑;
②草酸亚铁晶体中的铁元素质量为:3.6g×56/180=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,氧化物中氧元素的质量为:1.60g-1.12g=0.48g,铁元素和氧元素的质量比为:1.12g:0.48g=7:3,设铁的氧化物的化学式为FexOy,则有:56x:16y=7:3,解得x:y=2:3,铁的氧化物的化学式为Fe2O3。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
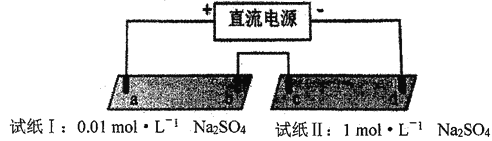
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快