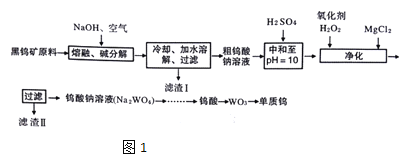
题目内容
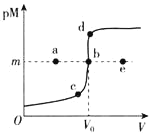
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用 0.1 mol·L-1KOH溶液分别滴定体积均为 20 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
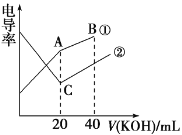
A.①表示的是 KOH溶液滴定盐酸溶液
B.A点的溶液中有c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C.C 点水电离的 c(OH-)小于 A 点水电离的 c(OH-)
D.在B点的溶液中有:c(CH3COO-)>c(K+)>c(H+)>c(OH-)
【答案】C
【解析】
溶液电导率与离子浓度成正比,HCl是强电解质,醋酸是弱电解质,因此相同浓度的盐酸和醋酸,盐酸中离子浓度大于醋酸,盐酸的电导率较大,根据图像,推出①是醋酸和KOH的混合,②是HCl和KOH的混合,据此分析;
A、溶液电导率与离子浓度成正比,HCl是强电解质,醋酸是弱电解质,因此相同浓度的盐酸和醋酸,盐酸中离子浓度大于醋酸,盐酸的电导率较大,根据图像,推出①是醋酸和KOH的混合,②是HCl和KOH的混合,故A错误;
B、A点溶液中,醋酸和KOH恰好完全反应,生成CH3COOK,根据电荷守恒,c(CH3COO-)+c(OH-)-c(H+)=c(K+),A点溶液的体积增加一倍,则离子浓度降为原来的一半,即c(CH3COO-)+c(OH-)-c(H+)=c(K+)=0.05mol·L-1,故B错误;
C、C点代表HCl和KOH恰好完全反应,溶质为KCl,对水的电离无影响,A点溶质为CH3COOK,促进水的电离,即C点水电离的c(OH-)小于A点水电离的c(OH-),故C正确;
D、B点溶质为CH3COOK和KOH,且两者物质的量相等,溶液显碱性,CH3COO-水解,但程度非常微弱,因此离子浓度大小顺序是c(K+)>c(OH-)>c(CH3COO-) >c(H+),故D错误;
答案为C。

【题目】已知反应2A(g)+2B(g)![]() C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
0 | 40 | 80 | 120 | 160 | |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
根据表中数据,下列说法正确的是
A.乙容器中的反应温度T<300
B.丙容器中,0-40min内用A的浓度变化表示的平均反应速率为为0.05mol/(L·min)
C.若起始时向甲容器中加入0.2、0.2、0.4和1.2,则反应将向正反应方向进行
D.在0-40min内,提高乙容器中的A的转化率的有效途径是使用高效催化剂