МвДїДЪИЭ
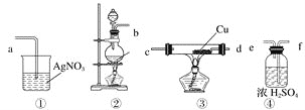
ЎѕМвДїЎїОЩКЗИЫµгЧоёЯµДЅрКфЈ¬КЗЦШТЄµДХЅВФОпЧКЎЈЧФИ»ЅзЦРОЩЦчТЄґжФЪУЪєЪОЩїуЦРЈ¬ЖдЦчТЄіЙ·ЦКЗМъєНГМµДОЩЛбСО(FeWO4ЎўMnWO4)Ј¬»№є¬ЙЩБїSiЎўAsµД»ЇєПОпЎЈУЙєЪОЩїуТ±Б¶ОЩµД№¤ТХБчіМИзНј1Јє
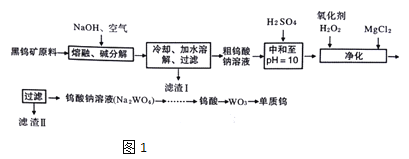
ТСЦЄЈє
ўЩВЛФьIµДЦчТЄіЙ·ЭКЗFe2O3ЎўMnO2
ўЪЙПКцБчіМЦРЈ¬ОЩµД»ЇєПјЫЦ»УРФЪЧоєуТ»ІЅ·ўЙъёД±дЎЈ
ўЫіЈОВПВОЩЛбДСИЬУЪЛ®ЎЈ
ЈЁ1Ј©ОЩЛбСО(FeWO4ЎўMnWO4)ЦРОЩФЄЛШµД»ЇєПјЫОЄ___Ј¬ЗлРґіцMnWO4ФЪИЫИЪМхјюПВ·ўЙъјо·ЦЅв·ґУ¦ЙъіЙFe2O3µД»ЇС§·ЅіМКЅ___
ЈЁ2Ј©ЙПКцБчіМЦРПтґЦОЩЛбДЖИЬТєЦРјУБтЛбЦРєНЦБpH=10єуЈ¬ИЬТєЦРµДФУЦКТхАлЧУИ·SiO32-ЎўHAsO32-ЎўHAsO42-µИЈ¬ФтЎ°ѕ»»ЇЎ±№эіМЦРЈ¬јУИлH2O2К±·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅОЄ___Ј¬ВЛФьўтµДЦчТЄіЙ·ЦКЗ___
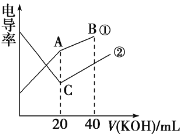
ЈЁ3Ј©ТСЦЄЗвСх»ЇёЖєНОЩЛбёЖ(CaWO4)¶јКЗОўИЬµзЅвЦКЈ¬БЅХЯµДИЬЅв¶ИѕщЛжОВ¶ИЙэёЯ¶шјхРЎЎЈНј2ОЄІ»Н¬ОВ¶ИПВCa(OH)2ЎўCaWO4µДіБµнИЬЅвЖЅєвЗъПЯЈ¬ФтЈє

ўЩT1___T2(МоЎ°>Ў±»тЎ°<Ў±)T1К±Ksp(CaWO4)=___
ўЪЅ«ОЩЛбДЖИЬТєјУИлКЇ»ТИйµГµЅґуБїОЩЛбёЖЈ¬·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅОЄ___ЎЈ
Ўѕґр°ёЎї+6 4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O H2O2+HAsO32-=HAsO42-+H2O MgSiO3ЎўMgHAsO4 < 1ЎБ10-10 WO42-+Ca(OH)2=CaWO4+2OH-
2Fe2O3+4Na2WO4+4H2O H2O2+HAsO32-=HAsO42-+H2O MgSiO3ЎўMgHAsO4 < 1ЎБ10-10 WO42-+Ca(OH)2=CaWO4+2OH-
ЎѕЅвОцЎї
єЪОЩїуЦРЦчТЄіЙ·ЦКЗFeWO4ЎўMnWO4Ј¬є¬ЙЩБїSiЎўAsµД»ЇєПОпЈ¬ИЫИЪЎўјо·ЦЅвїЙ·ўЙъБЅёц·ґУ¦Ј¬
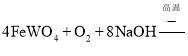
![]() АдИґјУЛ®ИЬЅв№эВЛЈ¬ВЛФь1ОЄЦчТЄіЙ·ЭКЗFe2O3ЎўMnO2Ј¬µГµЅµДґЦОЩЛбДЖИЬТєјУБтЛбЦРєНЦБpH=10єуЈ¬јУИл№эСх»ЇЗвЈ¬Ѕ«
АдИґјУЛ®ИЬЅв№эВЛЈ¬ВЛФь1ОЄЦчТЄіЙ·ЭКЗFe2O3ЎўMnO2Ј¬µГµЅµДґЦОЩЛбДЖИЬТєјУБтЛбЦРєНЦБpH=10єуЈ¬јУИл№эСх»ЇЗвЈ¬Ѕ«![]() Сх»ЇОЄ
Сх»ЇОЄ![]() Ј¬АлЧУ·ЅіМКЅОЄЈє
Ј¬АлЧУ·ЅіМКЅОЄЈє![]() Ј¬јУИлВИ»ЇГѕЈ¬ЙъіЙДСИЬУЪЛ®µД
Ј¬јУИлВИ»ЇГѕЈ¬ЙъіЙДСИЬУЪЛ®µД![]() Ўў
Ўў![]() Ј¬№эВЛЈ¬ВЛФьўтОЄЈ¬
Ј¬№эВЛЈ¬ВЛФьўтОЄЈ¬![]() Ўў
Ўў![]() ЎЈ
ЎЈ
![]() ОЩЛбСО
ОЩЛбСО![]() Ўў
Ўў![]() ЦРМъФЄЛШЎўГМФЄЛШ»ЇєПјЫОЄ
ЦРМъФЄЛШЎўГМФЄЛШ»ЇєПјЫОЄ![]() јЫЈ¬СхФЄЛШ
јЫЈ¬СхФЄЛШ![]() јЫЈ¬»ЇєПОпЦР»ЇєПјЫґъКэєНОЄ0Ј¬ФтОЩФЄЛШµД»ЇєПјЫОЄ
јЫЈ¬»ЇєПОпЦР»ЇєПјЫґъКэєНОЄ0Ј¬ФтОЩФЄЛШµД»ЇєПјЫОЄ![]() Ј»єЪОЩїуµДЦчТЄіЙ·ЦКЗМъєНГМµДОЩЛбСОЈ¬ёщѕЭБчіМНјµДМбКѕЦЄЈ¬єЪОЩїуФЪїХЖшЦРИЫИЪЙъіЙ
Ј»єЪОЩїуµДЦчТЄіЙ·ЦКЗМъєНГМµДОЩЛбСОЈ¬ёщѕЭБчіМНјµДМбКѕЦЄЈ¬єЪОЩїуФЪїХЖшЦРИЫИЪЙъіЙ![]() Ўў
Ўў![]() Ј¬Ўў
Ј¬Ўў![]() µИЈ¬»ЇС§·ґУ¦·ЅіМКЅОЄ
µИЈ¬»ЇС§·ґУ¦·ЅіМКЅОЄ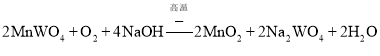 Ј¬
Ј¬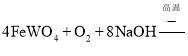
![]() Ј»№Кґр°ёОЄЈє
Ј»№Кґр°ёОЄЈє![]() Ј»
Ј»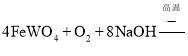
![]() Ј»
Ј»
![]() јУИл№эСх»ЇЗвЈ¬
јУИл№эСх»ЇЗвЈ¬![]() Сх»ЇОЄ
Сх»ЇОЄ![]() Ј¬АлЧУ·ЅіМКЅОЄЈє
Ј¬АлЧУ·ЅіМКЅОЄЈє![]() Ј¬јУИлВИ»ЇГѕЈ¬ЙъіЙДСИЬУЪЛ®µД
Ј¬јУИлВИ»ЇГѕЈ¬ЙъіЙДСИЬУЪЛ®µД![]() Ўў
Ўў![]() Ј¬№эВЛЈ¬ВЛФьўтОЄЈє
Ј¬№эВЛЈ¬ВЛФьўтОЄЈє![]() Ўў
Ўў![]() Ј»№Кґр°ёОЄЈє
Ј»№Кґр°ёОЄЈє![]() Ј»
Ј»![]() Ўў
Ўў![]() Ј»
Ј»
![]() ёщѕЭНјПуїЙЦЄЈ¬ЗвСх»ЇёЖєНОЩЛбёЖ
ёщѕЭНјПуїЙЦЄЈ¬ЗвСх»ЇёЖєНОЩЛбёЖ![]() ФЪёЖАлЧУЕЁ¶ИПаН¬К±Ј¬
ФЪёЖАлЧУЕЁ¶ИПаН¬К±Ј¬![]() ОВ¶ИПВТхАлЧУЕЁ¶ИґуУЪ
ОВ¶ИПВТхАлЧУЕЁ¶ИґуУЪ![]() Ј¬ЛµГч
Ј¬ЛµГч![]() К±µДИЬ¶И»эґуУЪ
К±µДИЬ¶И»эґуУЪ![]() Ј¬ИЬ¶И»эФЅґуЈ¬ФтИЬЅв¶ИФЅґуЈ¬ЛщТФ
Ј¬ИЬ¶И»эФЅґуЈ¬ФтИЬЅв¶ИФЅґуЈ¬ЛщТФ![]() К±ИЬЅв¶ИЅПґуЈ¬УЙУЪЎ°ТСЦЄЗвСх»ЇёЖєНОЩЛбёЖ
К±ИЬЅв¶ИЅПґуЈ¬УЙУЪЎ°ТСЦЄЗвСх»ЇёЖєНОЩЛбёЖ![]() ¶јКЗОўИЬµзЅвЦКЈ¬БЅХЯµДИЬЅв¶ИѕщЛжОВ¶ИЙэёЯ¶шјхРЎЎ±Ј¬Фт
¶јКЗОўИЬµзЅвЦКЈ¬БЅХЯµДИЬЅв¶ИѕщЛжОВ¶ИЙэёЯ¶шјхРЎЎ±Ј¬Фт![]() Ј¬
Ј¬![]() К±
К±![]() Ј¬№Кґр°ёОЄЈє
Ј¬№Кґр°ёОЄЈє![]() Ј»
Ј»![]() Ј»
Ј»
![]() Ѕ«ОЩЛбДЖИЬТєјУИлКЇ»ТИйЈ¬·ўЙъёґ·ЦЅв·ґУ¦Ј¬ЗвСх»ЇёЖєНОЩЛбёщАлЧУ·ґУ¦ЙъіЙОЩЛбёЖіБµнЈ¬·ґУ¦µДАлЧУ·ЅіМКЅОЄЈє
Ѕ«ОЩЛбДЖИЬТєјУИлКЇ»ТИйЈ¬·ўЙъёґ·ЦЅв·ґУ¦Ј¬ЗвСх»ЇёЖєНОЩЛбёщАлЧУ·ґУ¦ЙъіЙОЩЛбёЖіБµнЈ¬·ґУ¦µДАлЧУ·ЅіМКЅОЄЈє![]() Ј»№Кґр°ёОЄЈє
Ј»№Кґр°ёОЄЈє![]() ЎЈ
ЎЈ

 ГыРЈБЄГЛїмАЦїОМГПµБРґр°ё
ГыРЈБЄГЛїмАЦїОМГПµБРґр°ё »ЖёФґґУЕѕнПµБРґр°ё
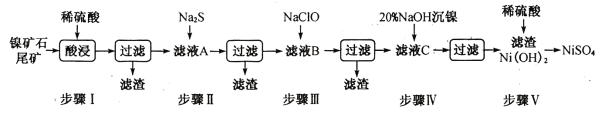
»ЖёФґґУЕѕнПµБРґр°ёЎѕМвДїЎїґУДшїуКЇОІїуЦРМбИЎNiSO4КЗЅвѕцОТ№ъДшЧКФґШС·¦µДТ»МхЦШТЄНѕѕ¶Ј¬ТСЦЄёГ№эіМИзПВЈє
±н1ЈєёчОпЦКµДKspКэѕЭИзПВ±нЈє
ОпЦК | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5ЎБ10-13 | 1.1ЎБ10-21 | 8.0ЎБ10-28 | 6.3ЎБ10-36 | 2.0ЎБ10-15 |
±н2ЈєВЛТєAЦРёчЅрКфАлЧУµДє¬БїИзПВ±нЈє
іЙ·Ц | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | ЎЎ |
є¬Бї/gЎ¤L-1 | 3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | ЎЎ |
ёщѕЭТФЙПРЕПўЈ¬»ШґрПВБРОКМвЈє
(1)ІЅЦиIЛбЅюЦ®З°РиЅ«їуКЇ·ЫЛйЈ¬ДїµДКЗ_______________ЎЈ
(2)
(3)іЈОВПВЅшРРІЅЦиўуµДДїµДКЗОЄБЛіэИҐМъєНГМФЄЛШЈ¬ТСЦЄіэМъФЄЛШµДАлЧУ·ґУ¦ИзПВЈє2Fe2++ ClO - +5H2O=2Fe( OH)3Ўэ+Cl- +4H+Ј¬ґЛК±Mn2+µДСх»ЇІъОпОЄMnO2Ј¬РґіціэГМФЄЛШµДАлЧУ·ЅіМКЅ_____________ЎЈ
(4)ЛщµГNi(OH)2КЗЦЖФмДшпУµзіШµДЦШТЄФБПЈ¬ДшпУµзіШ№¤ЧчФАнИзПВЈєCd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2Ј¬ФтЛжЧЕ·ЕµзµДЅшРРЈ¬Хэј«ЗшpH______(МоЎ°ФцґуЎ±ЎўЎ°јхРЎЎ±»тЎ°І»±дЎ±)Ј»ідµзК±Тхј«µзј«·ґУ¦КЅОЄ______________________ЎЈ
Cd(OH)2+2Ni(OH)2Ј¬ФтЛжЧЕ·ЕµзµДЅшРРЈ¬Хэј«ЗшpH______(МоЎ°ФцґуЎ±ЎўЎ°јхРЎЎ±»тЎ°І»±дЎ±)Ј»ідµзК±Тхј«µзј«·ґУ¦КЅОЄ______________________ЎЈ