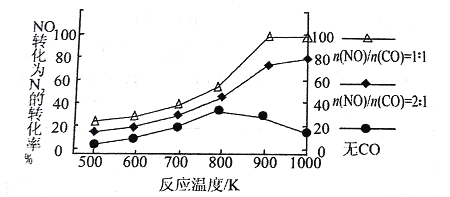
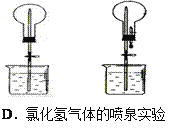
题目内容
【题目】下列性质的比较中,正确的是
A.非金属性:Br>ClB.稳定性:H2S>H2O
C.酸性:H2CO3>HNO3D.碱性:Ca(OH)2>Mg(OH)2
【答案】D
【解析】
A.同主族元素从上到下元素的非金属性逐渐减弱,则非金属性 Cl>Br,故A错误;
B.非金属性O>S,非金属性越强,氢化物稳定性越强,则氢化物稳定性: H2O>H2S,故B错误;
C.非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性N>C,则酸性:H2CO3<HNO3,故C错误;
D.金属性Ca>Mg,元素的金属性越强,对应的最高价氧化物的碱性越强,则碱性:Ca(OH)2>Mg(OH)2,故D错误;
答案选D。

【题目】如图为实验室利用少量Cu片和过量浓硝酸制取NO2气体的装置。
(1)烧瓶中产生气体的颜色是_________;

(2)反应结束后,将烧瓶浸入冰水中,发生反应2NO2(g)![]() N2O4(g)ΔH=-53kJ/mol。此时烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用相关化学用语和必要的文字说明颜色变化的原因__________________________________。
N2O4(g)ΔH=-53kJ/mol。此时烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用相关化学用语和必要的文字说明颜色变化的原因__________________________________。
(3)在80℃时,将0.40molN2O4气体充入2L已经抽成真空的固定容积的密闭容器I中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算a=_________,此温度时该反应(N2O4作为反应物)的平衡常数K=_________。
反应达平衡时,共吸收热量________kJ。
②在其他条件不变时,改变条件,使反应再次达到平衡,能使c(NO2)/c(N2O4)比值变小的措施有(填字母)________。
A.降低温度 B.使用高效催化剂
C.升高温度 D.通入稀有气体,使容器内压强增大