题目内容
11. 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
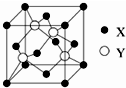
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.(1)X与Y所形成化合物晶体的晶胞如图所示.
①在1个晶胞中,X离子的数目为4.
②该化合物的化学式为ZnS.若其晶胞边长为540.0pm,则密度为4.1g/cm3,X与最近的Y之间的距离为$\frac{270}{\sqrt{1-cos10{9}^{°}2{8}^{′}}}$pm
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是sp3.
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为正四面体(用文字描述).
②写出一种与YZ42-互为等电子体的分子的化学式:CCl4或SiCl4.
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为16NA或16×6.02×1023个.
分析 元素X位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,则X为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,据此进行解答.
解答 解:元素X位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,则X为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,
(1)①根据晶胞结构可知,黑球X处于顶点和面上,则黑球的个数为:$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,
故答案为:4;
②白球全部在晶胞内部,该晶胞中含有白球个数是4,黑球处于顶点和面上,则黑球的个数为4,则二者形成的化合物为ZnS;该晶胞中含有4个ZnS,则其密度为:ρ=$\frac{\frac{M}{{N}_{A}}}{V}$=$\frac{4×\frac{65+32}{6.02×1{0}^{23}}g}{(540×1{0}^{-10}{cm)}^{3}}$=4.1g/(cm)3;
每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270$\sqrt{2}$pm,设S2-离子与Zn2+离子之间的距离为x,2x2-2x2cos109°28′=(270$\sqrt{2}$pm)2,
则:x=$\sqrt{\frac{(270\sqrt{2}pm)^{2}}{2(1-cos10{9}^{°}2{8}^{′})}}$=$\frac{270}{\sqrt{1-cos10{9}^{°}2{8}^{′}}}$pm;
故答案为:ZnS;4.1g/cm3;$\frac{270}{\sqrt{1-cos10{9}^{°}2{8}^{′}}}$pm;
(2)H2S分子中,S原子的价层电子数=$\frac{6+2}{2}$=4,所以S原子的轨道的杂化类型是sp3杂化,
故答案为:sp3;
(3)①SO42-中S原子的价层电子数=4+$\frac{1}{2}$(6+2-4×2)=4,且没有孤电子对,所以是正四面体结构,
故答案为:正四面体;
②YZ42-为SO42-,其含有的电子数为:16+4×8+2=50,与其等电子体的分子有:CCl4、SiCl4,
故答案为:CCl4或SiCl4;
(4)配合物[Zn(NH3)4]Cl2中,锌离子与氨分子之间有4个配位键,每个氨分子中有3个共价键,所以1mol该配合物中含有配位键的数目为:16NA或16×6.02×1023个,
故答案为:16NA或16×6.02×1023个.
点评 本题主要考查了位置、结构与性质关系的应用及晶胞计算,题目难度较大,涉及原子杂化方式、离子的空间构型、等电子体、晶胞计算等知识,元素推断是解题的关键,注意掌握原子结构与元素周期表、元素周期律的关系,明确晶胞计算的方法,试题侧重考查学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | HF | B. | HCl | C. | HBr | D. | HI |
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | NH4Cl的电子式: | |
| C. | H、D、T互为同素异形体 | |
| D. | Cl的原子结构示意图: |
| A. | 豆浆 | B. | NaCl溶液 | C. | HCl | D. | 空气 |
| A. | 某烃的分子式为 C10H14,它不能使溴水因反应而褪色,但可使酸性 KMnO4 溶液褪色,且分子结构中只有一个烷基,符合条件的芳香烃有 4 种(已知: KMnO44氧化) KMnO44氧化) | |
| B. | 2,4-二甲基-3,3-二乙基戊烷的一氯代物有4种 | |
| C. | 甲烷与氯气的混合气体在光照条件下反应生成的有机化合物均无同分异构体 | |
| D. | 乙烷与丙烯的物质的量共 1mol,完全燃烧生成 3molH2O |
| A. | CH4+2 O2$\stackrel{点燃}{→}$CO2+H2O | |
| B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | |
| C. | 2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2 H2O | |
| D. |  |
 .
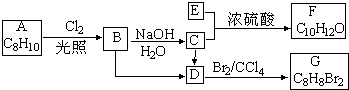
. ,E+C→F
,E+C→F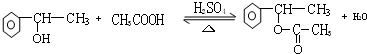
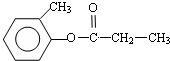
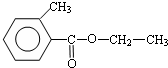
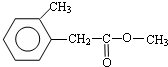
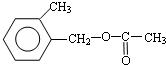

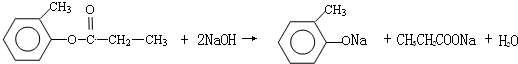 .
.

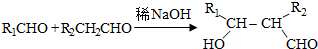
 .
. .
. ;
; (写结构简式)
(写结构简式)