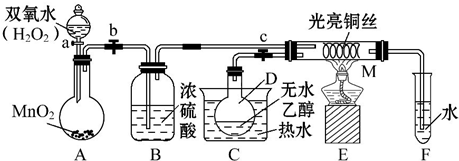
题目内容
2.设nA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| B. | 标准状况下,22.4 L 苯含有nA个苯分子 | |
| C. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 | |
| D. | 标准状况下,2.24 LCH4和C2H4混合气体中含有的H原子数为0.4nA |
分析 A、溶液体积不明确;
B、标况下,苯为液态;
C、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子;
D、求出混合气体的物质的量,然后根据CH4和C2H4均含4个氢原子来分析.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数不明确,故A错误;
B、标况下,苯为液态,故不能根据气体摩尔体积来计算,故B错误;
C、7.8g过氧化钠的物质的量n=$\frac{7.8g}{78g/mol}$=0.1mol,而过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子,则0.1mol过氧化钠转移0.1mol电子即0.1nA个,故C错误;
D、标况下,2.24L混合气体的物质的量为0.1mol,而CH4和C2H4均含4个氢原子,故0.1mol混合气体中含0.4mol氢原子即0.4nA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构及状态是解题的关键,难度不大.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
19.设NA为阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 在28g聚乙烯中,含有的碳原子个数为2NA | |
| B. | 在合成28g聚乙烯的单体中,含有NA个碳碳双键 | |
| C. | 在28g聚乙烯中,含有C-H的数目为4NA | |
| D. | 28g聚乙烯完全燃烧时,转移电子数为3NA |
20.天然维生素P(结构简式如图所示)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述中错误的是( )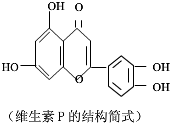

| A. | 可与NaOH溶液反应,1mol该物质可与4mol NaOH反应 | |
| B. | 可与溴水反应,且1mol该物质与足量溴水反应消耗6mol Br2 | |
| C. | 一定条件下1mol该物质可与H2加成,耗H2最大量为7mol | |
| D. | 维生素P遇FeCl3溶液发生显色反应 |
14.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:1,则下列说法中正确的是( )
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 分子中含有氧原子 | D. | 此有机物的最简式为为CH4 |
11.下列说法正确的是( )
| A. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A一定是强酸 | |
| B. | 用已知浓度的盐酸滴定未知浓度的氨水,选用最佳指示剂为酚酞 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 常温下,强酸溶液的pH=a,将溶液的体积稀释到原来的10n倍,则pH=a+n |
12.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)有图Ⅰ和图Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数),试判断下列说法中正确的是( )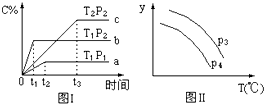

| A. | 正反应为放热,T1>T2 | |
| B. | x=1,P2<P1 | |
| C. | y轴表示混合气体的平均分子量,P3<P4 | |
| D. | y轴表示B的转化率,P3>P4 |
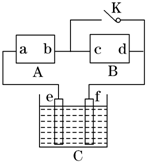 如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: