题目内容
5.下列有关溶液的描述正确的是( )| A. | 1 mol•L-1的FeCl3溶液中,Fe3+离子个数小于NA | |
| B. | Al3+和S2-,NO3-和S2-两组离子在酸、碱和中性溶液中均不能大量共存 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应的离子方程式:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| D. | 向10 mL 0.1 mol•L-1 CH3COONa溶液中加入5 mL 0.1 mol•L-1盐酸时,溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
分析 A.缺少氯化铁溶液的体积,无法计算铁离子的数目;
B.NO3-和S2在中性、碱性溶液中能够共存;
C.氢氧化钠过量,离子方程式按照碳酸氢钙的化学式组成书写;
D.反应后溶质为等浓度的醋酸钠和醋酸,醋酸的电离程度大于其水解程度,则:c(H+)>c(OH-)、c(CH3COO-)>c(CH3COOH).
解答 解:A.没有告诉氯化铁溶液的体积,无法计算铁离子的物质的量及数目,故A错误;
B.Al3+和S2-一定不能共存,而NO3-和S2在中性、碱性溶液中能够共存,故B错误;
C.Ca(HCO3)2溶液与过量NaOH溶液反应生成碳酸钠、碳酸钙沉淀和水,正确的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.10 mL 0.1 mol•L-1 CH3COONa溶液中加入5 mL 0.1 mol•L-1盐酸时,反应后溶质为等浓度的醋酸钠和醋酸,醋酸的电离程度大于其水解程度,则:c(H+)>c(OH-)、c(CH3COO-)>c(CH3COOH),溶液中离子浓度大小为:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较、离子方程式书写、离子共存、阿伏伽德罗常数的应用等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生灵活应用基础知识的能力,注意掌握离子共存的条件、离子方程式的书写原则,明确判断离子浓度大小常用方法.

练习册系列答案
相关题目
16.下列说法不正确的是( )
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 某物质的结构为 ,与其互为同分异构且完全水解后产物相同的油脂有两种 ,与其互为同分异构且完全水解后产物相同的油脂有两种 | |
| C. | 用溴水即可鉴别四氯化碳、2-己烯和甲苯 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
13. 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中X点的坐标为(10,6) | |
| C. | 图中X点对应溶液中Ag+与Cl-的浓度不相同 | |
| D. | 若把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
20.以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )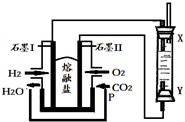

| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | X端为电解池的阳极 |
10.列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | CaSO3是难溶物 | 向CaCl2溶液中通入SO2产生白色沉淀 |
| B | 明矾能水解生成Al(OH)3胶体 | 实验室用明矾与水反应制Al(OH)3 |
| C | SiO2是酸性氧化物 | SiO2与任何酸均不反应 |
| D | Zn具有还原性和导电性 | 可用作锌锰干电池的负极材料 |
| A. | A | B. | B | C. | C | D. | D |
17. 柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
 柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )| A. | BAP导电性优良,因其有共轭双键结构 | |
| B. | 五环多环芳香烃类都是BAP的同分异构体 | |
| C. | BAP有10种一硝基取代物 | |
| D. | BAP的分子式为C20H12 |
15.下列图象表达正确的是( )
| A. | 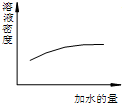 浓硫酸的稀释 浓硫酸的稀释 | |
| B. | 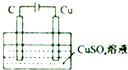 某电极上有铜产生,且溶液中铜离子浓度不变 | |
| C. |  微粒电子数 微粒电子数 | |
| D. | 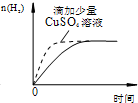 过量的盐酸和等量的锌粉反应 过量的盐酸和等量的锌粉反应 |
 ;
;