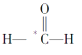题目内容
【题目】(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
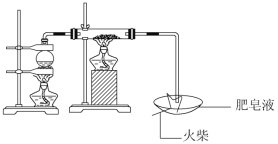
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当肥皂泡爆破,并有爆鸣声时,说明“铁与水蒸气”能够进行反应,写出铁与水蒸气反应的化学方程式__________________________。
(2)为了研究(1)中一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积(已折算成标准状况)。
①收集并测量气体体积应选下图中的________装置。
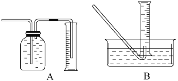
②称取0.24 g铁粉与适量石棉绒混合,然后加热至无气体放出。最好选用__________规格的量筒(选填字母序号)。
A.100 mL B.200 mL C.500 mL D.1 000 mL
(3)现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。
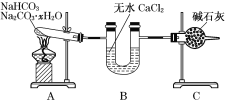
①若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为______。
②该装置还不是很完善,可能使测定结果偏小,应如何改进_____________________________。原因是___________________________________________________________________________。
【答案】3Fe+4H2O(g) ![]() Fe3O4+4H2 B B 10 在C装置后再加一个装有碱石灰的干燥管(符合题意即可) 为了防止空气中的CO2和H2O被C装置中的碱石灰吸收
Fe3O4+4H2 B B 10 在C装置后再加一个装有碱石灰的干燥管(符合题意即可) 为了防止空气中的CO2和H2O被C装置中的碱石灰吸收
【解析】
(1)点燃的火柴靠近肥皂泡,肥皂泡爆破,并有爆鸣声时说明有氢气生成,反应方程式为:![]() ;
;
(2)①生成的气体为氢气,可用排水法和向下排空气法收集,故答案为:B;
②0.24 g铁粉的物质的量为0.24g/56≈0.0043mol,生成的氢气约为(0.0043/3)×4≈0.0057mol,标况下体积约为128ml,故答案为:B;
(3)①用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22 g,这说明反应中生成的水蒸气质量为1.89g,CO2质量为0.22g,物质的量分别是![]() =0.105mol、
=0.105mol、![]() =0.005mol。根据反应的方程式2NaHCO3
=0.005mol。根据反应的方程式2NaHCO3![]() Na2CO3+H2O+CO2↑可知,该反应中生成的CO2为0.005mol,则碳酸氢钠的物质的量是0.005mol×2=0.01mol,反应中生成的水是0.005mol。则碳酸钠在反应中失去的水的物质的量=0.105mol-0.005mol=0.100mol。碳酸氢钠的质量=0.01mol×84g/mol=0.84g,则样品中碳酸钠晶体的质量=3.7g-0.84g=2.86g。则[
Na2CO3+H2O+CO2↑可知,该反应中生成的CO2为0.005mol,则碳酸氢钠的物质的量是0.005mol×2=0.01mol,反应中生成的水是0.005mol。则碳酸钠在反应中失去的水的物质的量=0.105mol-0.005mol=0.100mol。碳酸氢钠的质量=0.01mol×84g/mol=0.84g,则样品中碳酸钠晶体的质量=3.7g-0.84g=2.86g。则[![]() =0.1mol,解得x=10。故答案为:10;
=0.1mol,解得x=10。故答案为:10;
②由于空气中也含有CO2和水蒸气,也能被C装置的中碱石灰吸收,从而导致C管增重偏高,因此测量值偏低。故答案为:在C装置后再加一个装有碱石灰的U形管;为了防止空气中的CO2和H2O被C装置的中的碱石灰吸收。