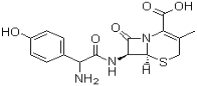
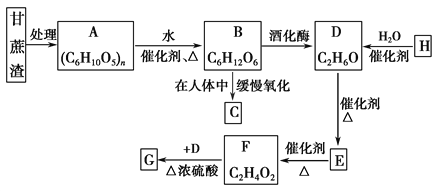
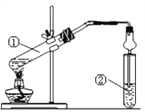
��Ŀ����
����Ŀ��ŷ�����պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȡ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1�����������ҹ�����̼�����о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼�����������ʣ�������̼���������������������ᴿ������ɲ���ƽ������ѧ����ʽ��
��C����K2Cr2O7+��______=��CO2��+��K2SO4+��Cr2(SO4)3+��H2O
��2���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+2H2(g)=CH3OH(g) ��H1=-116kJ/mol
�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ���_______������ĸ���ţ���
A����ʱ��CH30H�뷴Ӧ�������� B.���ͷ�Ӧ�¶�
C.������ϵѹǿ D.ʹ�ø�Ч����
����֪��CO(g)+1/2O2(g)=CO2(g) ��H2=-283kJ/mol
H2(g)+1/2O2(g)=H2O(g) ��H3=-242kJ/mol
���ʾlmol��̬�״���ȫȼ������CO2��ˮ����ʱ���Ȼ�ѧ����ʽΪ______________��
�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250���270�� �����¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊlmol����COƽ��ת���ʵĹ�ϵ��

��ش�
i�������������¶��У�����Z��Ӧ���¶���_________��
ii������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶��£���ӦCO(g)+2H2(g)=CH3OH(g)��ƽ�ⳣ��K=__________��
��3��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10-9�� CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ5.6��10-5mol/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ______________��
���𰸡� 3��2��8��H2SO4��3��2��2��8 CD CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ��H=-651kJ/mol 270�� 4L2/mol2�����Բ�д��λ�� 2��10-4mol/L
����������1����Ӧ��CԪ�صĻ��ϼ���0������Ϊ+4�ۣ�CrԪ�صĻ��ϼ���+6�۽���Ϊ+3�ۣ��÷�Ӧ��ת��12e-���ɵ����غ�������غ㶨�ɿɵ�֪��ѧ��ӦΪ��3C+2K2Cr2O7+8H2SO4=3CO2��+2K2SO4+2Cr2(SO4)3+8H2O��
��2����A����ʱ��CH3OH�뷴Ӧ�������룬û�иı䷴Ӧ���ʣ�ѡ��A����B���¶Ƚ��ͣ���Ӧ���ʱ�С��ѡ��B����C��ѹǿ����Ӧ���ʼӿ죬ѡ��C��ȷ��D��ʹ�ô�������Ӧ���ʼӿ죬ѡ��D��ȷ����ѡCD��
�ڸ��ݷ�Ӧ����CO(g)+2H2(g)=CH3OH(g) ��H1=-116kJ/mol
��CO(g)+1/2O2(g)=CO2(g) ��H2=-283kJ/mol��
��H2(g)+1/2O2(g)=H2O(g) ��H3=-242kJ/mol
���ݸ�˹���ɣ���-��-����2�ã�CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(g) ��H=��H1-��H2-2��H3=-651kJ/mol��
O2(g)=CO2(g)+2H2O(g) ��H=��H1-��H2-2��H3=-651kJ/mol��
��i�����ݷ�ӦCO(g)+2H2(g)=CH3OH(g) ��H1=-116kJ/mol���Ƿ��ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ͣ���������Z��Ӧ���¶���270����
ii��a��ʱ��COת����50%��
CO(g) + 2H2(g) = CH3OH(g)
��ʼʱŨ��/mol/L 1 1.5 0
ת����Ũ��/mol/L 0.5 1 0.5
ƽ��ʱŨ��/mol/L 0.5 0.5 0.5
K=![]() =
=![]() =4 L2/mol2��
=4 L2/mol2��
��3��Na2CO3��Һ��Ũ��Ϊ5.6��10-5mol/L���������Ϻ�c(CO32-)=![]() ��5.6��10-5mol/L=2.8��10-5mol/L������Ksp= c(CO32-) c(Ca2+)=2.8��10-9��֪��c(Ca2+)=
��5.6��10-5mol/L=2.8��10-5mol/L������Ksp= c(CO32-) c(Ca2+)=2.8��10-9��֪��c(Ca2+)=![]() =1��10-4 mol/L��ԭ��ҺCaCl2��Һ����СŨ��Ϊ�����Һ��c(Ca2+)��2������ԭ��ҺCaCl2��Һ����СŨ��Ϊ2��1��10-4 mol/L=2��10-4 mol/L��
=1��10-4 mol/L��ԭ��ҺCaCl2��Һ����СŨ��Ϊ�����Һ��c(Ca2+)��2������ԭ��ҺCaCl2��Һ����СŨ��Ϊ2��1��10-4 mol/L=2��10-4 mol/L��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��ú������Ҫ�ĺ���������H2S�Լ�COS���л���ú��ȼ�պ������ʻ�ת����SO2�Ӷ����������Ⱦ��ú����H2S���ѳ��̶��ѳ�Ϊ��ྻ�ȵ�һ����Ҫָ�ꡣ�ش��������⣺
(1)��H2Sͨ��FeCl3��Һ�У��÷�Ӧ�Ļ�ԭ����Ϊ___________��
(2)�ѳ�ú����COS�ķ�����Br2��KOH��Һ��������H2��ԭ���Լ�ˮ�ⷨ�ȡ�
��COS�ķ��ӽṹ��CO2���ƣ�COS�ĵ���ʽΪ_____________��
��Br2��KOH��Һ��COS����Ϊ�����κ�̼���ε����ӷ���ʽΪ_____________��
����֪����1mol��ѧ��������������£�
��ѧ�� | H��H | C�TO | C�TS | H��S | C��O |
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2��ԭCOS�����ķ�ӦΪH2(g)+COS(g) �TH2S(g)+CO(g)���÷�Ӧ�Ħ�H=________kJ��mol-1��
���û��Ԧ���Al2O3��COSˮ��ķ�ӦΪCOS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ��H<0����ͬͶ�ϱȡ���ͬ�������ڴ�������ͣ����ͬʱ��ʱ����ͬ�¶���COS��ת���ʣ�δ�ﵽƽ�⣩��ͼ1��ʾ��ij�¶��£�COS��ƽ��ת������
CO2(g)+ H2S (g) ��H<0����ͬͶ�ϱȡ���ͬ�������ڴ�������ͣ����ͬʱ��ʱ����ͬ�¶���COS��ת���ʣ�δ�ﵽƽ�⣩��ͼ1��ʾ��ij�¶��£�COS��ƽ��ת������![]() �Ĺ�ϵ��ͼ2��ʾ��
�Ĺ�ϵ��ͼ2��ʾ��


��ͼ1��֪�������������ʱ��Ӧ���¶�ԼΪ____________����ͼ2��֪��P��ʱƽ�ⳣ��K=_____
������2λ��Ч���֣���
(3)�����¿ɷ�����Ӧ��ZnS(s)+2H+(aq) ![]() Zn2+(aq)+H2S(aq)���ﵽƽ��ʱ���÷�Ӧ��ƽ�ⳣ��K=_______[��֪��Ksp(ZnS)=2.93��10-25��H2S���볣����Ka1=9.5��10-8��Ka2=1.3��10-14]��
Zn2+(aq)+H2S(aq)���ﵽƽ��ʱ���÷�Ӧ��ƽ�ⳣ��K=_______[��֪��Ksp(ZnS)=2.93��10-25��H2S���볣����Ka1=9.5��10-8��Ka2=1.3��10-14]��