��Ŀ����
����Ŀ��ij���dz��Ը���Ϊԭ�����ǣ�ͬʱ�õ������ĸ��������Ը����������ۺ����ò�����������ۺ�Ч�棬���һ��ܷ�ֹ������Ⱦ�������������£�
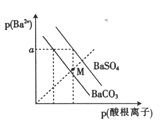
��֪ʯ���ѽ��ѳ�Ϊ����H����Ҫ������E����Һ�ܷ���������Ӧ��G�Ǿ�����ζ��Һ�壬�Իش��������⡣
(1) D�ĽṹʽΪ_______________________________________��
(2) H��D�Ļ�ѧ��Ӧ����Ϊ______________________________��
(3) F��G�ķ�Ӧװ����ͼ��ʾ��
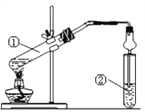
a.ͼ�е������θ���ܵ�����_____________________________��
b.�Թܢ��м��б���Na2CO3��Һ���������ǣ� ____________________��
c. ��184 g D��90 g F��Ӧ������106 g G����÷�Ӧ�IJ���Ϊ___________��
����֪��![]() ��
��
(4) D��E�Ļ�ѧ����ʽ��________________________��
(5) д��H�����Ӿ۷�Ӧ�ķ���ʽ��_________________��
(6) д��������������Ҫ������ʵĽṹ��ʽ��______________________��
����CH3CH2COOH��Ϊͬ���칹�� ����G������ͬ������
���𰸡�  �ӳ� .������ �ܽ��Ҵ����к����ᣬ�������������ܽ�� 80.3% 2CH3CH2OH + O2
�ӳ� .������ �ܽ��Ҵ����к����ᣬ�������������ܽ�� 80.3% 2CH3CH2OH + O2![]() 2CH3CHO +2H2O
2CH3CHO +2H2O ![]() HCOOC2H5 CH3COOCH3
HCOOC2H5 CH3COOCH3
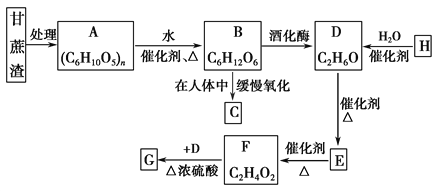
������������������֮��õ���ά�أ���ά��ˮ������ղ���Ϊ�����ǣ�����A����ά�أ�B�������ǣ��������ھƻ�ø�������·�Ӧ�����Ҵ�����D���Ҵ���D��������������EΪCH3CHO��E��һ������������Ӧ����FΪCH3COOH��F��D����������Ӧ����GΪCH3COOCH2CH3�������������������������õ�������̼��ˮ��H��ˮ��Ӧ�ﵽ�Ҵ�����HΪCH2=CH2��
(1) D���Ҵ����ṹʽΪ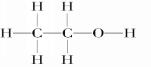 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(2) ��ϩ��ˮ�ӳɷ�Ӧ�����Ҵ�����Ӧ�Ļ�ѧ����ʽΪCH2 = CH2 + H2O![]() CH3CH2OH���ʴ�Ϊ���ӳɷ�Ӧ��
CH3CH2OH���ʴ�Ϊ���ӳɷ�Ӧ��
(3) a.�������θ���ܿ��Է��������ʴ�Ϊ����������
b.�Թܢ��м��б���Na2CO3��Һ�������ܽ��Ҵ����к����ᣬ�������������ܽ�ȣ��ʴ�Ϊ���ܽ��Ҵ����к����ᣬ�������������ܽ�ȣ�
c. 184g�Ҵ������ʵ�����184g��46g/mol=4mol��90g��������ʵ�����90g��60g/mol=1.5mol�������Ҵ��������Է�Ӧ��������������Ӧ�ð������������㣬������Ӧ�ò�������������������1.5mol��88g/mol=132g��ʵ�ʷ�Ӧ������106gE����÷�Ӧ�IJ���(106g��132g)��100%=80.3%���ʴ�Ϊ��80.3%��
(4) D��E�Ļ�ѧ����ʽ��2CH3CH2OH+O2![]() 2CH3CHO+2H2O���ʴ�Ϊ��2CH3CH2OH+O2
2CH3CHO+2H2O���ʴ�Ϊ��2CH3CH2OH+O2![]() 2CH3CHO+2H2O��
2CH3CHO+2H2O��
(5) H�����Ӿ۷�Ӧ�ķ���ʽ��n CH2=CH2![]()
![]() ���ʴ�Ϊ��n CH2=CH2
���ʴ�Ϊ��n CH2=CH2![]()
![]() ��
��
(6) GΪCH3COOCH2CH3������CH3CH2COOH��Ϊͬ���칹�� ����G������ͬ�����ţ�˵���������࣬����������ͬ���칹���У�HCOOC2H5 CH3COOCH3���ʴ�Ϊ��HCOOC2H5 CH3COOCH3��

����Ŀ����ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1����֪��3Fe2O3(s)+CO(g)=2Fe3O4(s)+4CO2(g) ��H1=-47kJ/mol��
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ��H2=-14kJ/mol��
��Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H=________��
��2��ú������ҵ�г���ͨ���о���ͬ�¶��·�Ӧ��ƽ�ⳣ�����������ʵ�����⡣���������CO��H2O(g)ͨ��һ�����ܱ������У�������Ӧ��CO(g)+H2O(g)![]() H2(g)+CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2(g)+CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶ȣ��� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�� �÷�Ӧ��ƽ�ⳣ������ʽK=_______���÷�Ӧ������Ӧ��_______��������������������������Ӧ��
�� ����Ӧ��800��ʱ����, CO��H2O(g)����ʼŨ�Ⱦ�Ϊ0.020 mol��L-1����������£�CO��ƽ��ת����Ϊ_________��
�� ���д�ʩ���ܹ����COת���ʵ���______������ĸ��
a�������¶� b��������� c������CO��Ũ�� d.����H2O(g)