题目内容
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、基准试剂、还原剂、除氯剂等。
Ⅰ、实验室制备硫代硫酸钠装置图如下。

(1)仪器B的名称是________。
(2)写出装置B制备Na2S2O3的化学反应方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、测硫代硫酸钠样品纯度步骤如下
①称取Ⅰ中制得硫代硫酸钠样品8.0g配成250mL溶液
②从①中量取20.00mL溶液于锥形瓶中
③用0.lmol·L-1标准碘液滴定,实验测得数据如下
滴定前读数(mL) | 滴定后读数(mL) | 待测液体积(mL) | |
实验一 | 1.20 | 21.00 | 20.00 |
实验二 | 0.40 | 19.20 | 20.00 |
实验三 | 0.50 | x | 20.00 |
(4)该滴定时,向锥形瓶中加入1至2滴淀粉液作指示剂,则达到滴定终点的判断标准是______________。
(5)x读数如图所示,则x=________,根据所测的数据计算该硫代硫酸钠样品纯度为_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
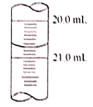
(6)若步骤①中量取20.00mL硫代硫酸钠溶液时,未用硫代硫酸钠溶液润洗滴定管,则测得样品的纯度将______________(填“偏大”或“偏小”)。
【答案】三颈烧瓶 2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2 吸收多余的SO2 滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色 20.70 98.75%或98.8% 偏小
【解析】
Ⅰ、(1)依据仪器构造作答;
(2)装置A中制备出的二氧化硫通入装置B中,此装置硫化钠与碳酸钠和通入的二氧化硫发生氧化还原反应生硫代硫酸钠,根据氧化还原反应规律与质量守恒定律书写其化学方程式;
(3)氢氧化钠可吸收二氧化硫;
Ⅱ、(4)淀粉溶液遇碘单质变蓝,据此分析;
(5)滴定管读数时,凹液面的最低处与刻度线相切,且要估读一位;根据实验数据得出消耗的碘液的体积,结合关系式I2~2S2O32-,得出样品中S2O32-的物质的量,进而计算样品的纯度;
(6)依据滴定实验操作不当可能带来的误差分析结果。
Ⅰ、(1)仪器B的名称为三颈烧瓶,
故答案为:三颈烧瓶;
(2)在装置B中利用Na2S、Na2CO3与SO2制备Na2S2O3,此反应为氧化还原反应,-2价的S元素升高到+2价,+4价的S元素降低到+2价,依据氧化还原反应规律配平该化学方程式为:2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2,
故答案为:2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2;
(3)NaOH溶液可吸收多余的SO2,防止污染环境,
故答案为:吸收多余的SO2;
Ⅱ、(4)根据给定的已知反应I2+2Na2S2O3=2NaI+Na2S4O6可知,硫代硫酸钠会使碘单质变成碘离子,则滴定时向锥形瓶中加入1至2滴淀粉液作指示剂,当滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色,则证明达到滴定终点,
故答案为:滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色;
(5)根据滴定管的读数规则可知,实验三滴定后读数为20.70mL,则三次实验得出消耗的标准碘液的体积分别为21.00 mL -1.20 mL =19.80mL、19.20 mL -0.40mL =18.80mL、20.70 mL -0.50 mL =20.20 mL,则可以看出第二实验误差太大,实验数据应该舍去,由此可知消耗的碘液的体积平均值为=![]() ,结合化学方程式,根据关系式I2~2S2O32-可得,则配制的20mL样品溶液中硫代硫酸钠的物质的量n=2n(I2)= 2×0.lmol·L-1×20.00×10-3L=4.00×10-3 mol,则原样品中含有的硫代硫酸钠的物质的量为4.00×10-3 mol ×
,结合化学方程式,根据关系式I2~2S2O32-可得,则配制的20mL样品溶液中硫代硫酸钠的物质的量n=2n(I2)= 2×0.lmol·L-1×20.00×10-3L=4.00×10-3 mol,则原样品中含有的硫代硫酸钠的物质的量为4.00×10-3 mol ×![]() =5×10-2 mol,所以样品纯度为
=5×10-2 mol,所以样品纯度为![]() ,
,
故答案为:20.70;98.75%或98.8%;
(6)待测的滴定管未用硫代硫酸钠溶液润洗,会使锥形瓶内待测液浓度偏低,消耗的碘液体积偏小,最终导致样品纯度偏小,
故答案为:偏小。

 培优好卷单元加期末卷系列答案
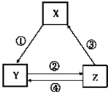
培优好卷单元加期末卷系列答案【题目】下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
选项 | X | Y | Z | 箭头上为反应条件或试剂 |
|
A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2,再通过量NH3 | |
C | MgO | MgCl2 | Mg(OH)2 | ③加热 | |
D | NaAlO2 | Al(OH)3 | Al2O3 | ④加水 |
A.AB.BC.CD.D