题目内容
19.已知常温下,HCOOH比NH3•H2O电离常数大.向10mL0.1mol/L HCOOH中滴加同浓度NH3•H2O,有关叙述正确的是( )| A. | 滴加过程中水的电离程度始终增大 | |
| B. | 当加入10mL NH3•H2O时,c(NH${\;}_{4}^{+}$)<c(HCOO-) | |
| C. | 当两者恰好中和时,溶液pH=7 | |
| D. | 滴加过程中c(HCOOH)与c(HCOO-)之和保持不变 |
分析 常温下,HCOOH比NH3•H2O电离常数大,说明相同浓度的HCOOH比NH3•H2O电离程度大,HCOO-不如NH4+水解程度大,据此分析.
解答 解:A、HCOOH能够抑制水的电离,滴加氨水过程中,水的电离程度增大,氨水过量时,抑制水的电离,所以滴加过程中水的电离程度先增大,恰好中和后再减小,故A错误;
B、加入10mL NH3•H2O时,恰好生成HCOONH4,HCOO-不如NH4+水解程度大,溶液显酸性,据电荷守恒可知c(NH4+)<c(HCOO-),故B正确;
C、两者恰好中和时生成HCOONH4,HCOO-不如NH4+水解程度大,溶液显酸性,故C错误;
D、滴加过程中n(HCOOH)与n(HCOO-)之和保持不变,溶液体积增大,浓度和减小,故D错误;
故选B.
点评 本题考查了弱电解质的电离和盐类水解的相关知识,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
9.将3mol A与3mol B混合于3L的密闭容器中,发生如下反应:2A(g)+3B(g)?2C(g)+nD(g),2s后达平衡A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断正确的是( )
| A. | v(B)=0.25 mol•L-1•s-1 | B. | C的体积分数为30% | ||
| C. | B的转化率为25% | D. | n=2 |
10.下列离子方程式中,正确的是( )
| A. | 铁粉与氯化铁溶液混合:Fe+Fe3+=2Fe2+ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
14.2015年诺贝尔生理学或医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )

| A. | 异胡薄荷醇的分子式为C10H17O | |
| B. | 异胡薄荷醇在NaOH醇溶液中可发生消去反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
4.有K2SO4、Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol•L-1,SO42-的物质的量为1.4mol,则此溶液中K+的物质的量浓度为0.2mol•L-1 则混合溶液的体积是( )
| A. | 1L | B. | 2L | C. | 3L | D. | 2.8 L |
11.下列化学用语正确的是( )
| A. | 次氯酸的化学式:HClO2 | B. | 硫离子的结构示意图: | ||
| C. | 质量数为127的钡原子:127Ba | D. | 氨气(NH3)中氮元素的化合价:+3 |
8.有关Na2CO3和NaHCO3的叙述中正确的是( )
| A. | 相同温度下,Na2CO3的溶解度大于NaHCO3 | |
| B. | NaHCO3比Na2CO3热稳定性强 | |
| C. | Na2CO3和NaHCO3均可与澄清石灰水反应 | |
| D. | Na2CO3和NaHCO3均不与NaOH溶液反应 |
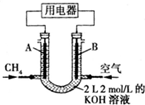 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
 .
.