题目内容
7.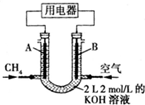 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.(1)0<V≤44.8L时,电池负极电极反应为CH4-8e-+10OH-=CO32-+7H2O;
(2)当消耗甲烷的体积为22.4L(标况下)时,转移电子的物质的量为8mol;此时溶液中KOH的物质的量浓度为1mol/L;(假设溶液体积不变).
分析 n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应,由此分析解答.
解答 解:n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
(1)当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,所以负极反应为:CH4-8e-+10OH-=CO32-+7H2O;故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(2)当消耗甲烷的体积为22.4L,n(CH4)=1mol,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,则转移电子的物质的量为8mol,消耗氢氧化钾为2mol,则此时溶液中KOH的物质的量浓度为$\frac{4-2}{2}$=1mol/L,故答案为:8mol;1mol/L.
点评 本题考查了通过计算书写燃料电池的电极反应式等重要考点,涉及的知识点较多,综合性较强,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
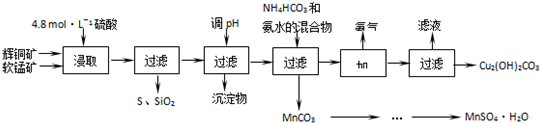
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;③部分金属阳离子生成氢氧化物沉淀 的pH范围如下表所示
(1)酸浸时,为了提高浸取率可采取的措施有粉碎矿石(或适当升高温度或搅拌)(任写一点).
(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O.
(3)调节浸出液pH的范围为3.2≤PH<4.4,其目的是使Fe3+离子转化为氢氧化铁沉淀除去.
(4)本工艺中可循环使用的物质是NH3(写化学式).
(5)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有混有硫酸盐杂质或部分晶体失去结晶水(任写一种).

已知:①MnO2能将金属硫化物中的硫氧化为单质硫;②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;③部分金属阳离子生成氢氧化物沉淀 的pH范围如下表所示
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O.
(3)调节浸出液pH的范围为3.2≤PH<4.4,其目的是使Fe3+离子转化为氢氧化铁沉淀除去.
(4)本工艺中可循环使用的物质是NH3(写化学式).
(5)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有混有硫酸盐杂质或部分晶体失去结晶水(任写一种).
18.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→
d Fe3++e Br2+f Cl-.下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
d Fe3++e Br2+f Cl-.下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
15.在100mL 0.1mol•L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )
| A. | 加热 | |
| B. | 加入100 mL 0.1 mol•L-1的醋酸溶液 | |
| C. | 加入少量的0.5 mol•L-1的硫酸 | |
| D. | 加入少量的1 mol•L-1的NaOH溶液 |
12.一定量的CuS投入足量的HNO3中,收集到气体V L(标准状况),已知气体为NO和NO2的混合物,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,则V可能为( )
| A. | 5.0 L | B. | 8.9 L | C. | 15.7 L | D. | 26.9 L |
19.已知常温下,HCOOH比NH3•H2O电离常数大.向10mL0.1mol/L HCOOH中滴加同浓度NH3•H2O,有关叙述正确的是( )
| A. | 滴加过程中水的电离程度始终增大 | |
| B. | 当加入10mL NH3•H2O时,c(NH${\;}_{4}^{+}$)<c(HCOO-) | |
| C. | 当两者恰好中和时,溶液pH=7 | |
| D. | 滴加过程中c(HCOOH)与c(HCOO-)之和保持不变 |
16.下列实验方法及判断不正确的是( )
| A. | 用NaOH溶液来鉴别NH4Cl和KCl | |
| B. | 用硝酸酸化的AgNO3溶液来鉴别NH4Cl和NH4NO3 | |
| C. | 某溶液中滴加BaCl2溶液后产生白色沉淀,则该溶液中一定含有SO42-离子 | |
| D. | 用焰色反应鉴别NaCl和KNO3 |
17.下列实验方法正确的是( )
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ | |
| B. | 配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可 | |
| C. | 用过量的NaOH溶液鉴别AlCl3溶液和MgCl2溶液 | |
| D. | 检验某溶液中是否含有Fe2+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe2+ |