题目内容
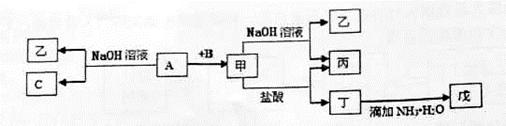
Ⅰ、物质的分离和提纯有多种方法。物质分离、提纯方案的设计在科学研究和工业生产中占有十分重要的地位。工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等,已知SiO2是不溶于水的酸性氧化物,Fe2O3是不溶于水的碱性氧化物)。某研究小组设计的提纯Al2O3的方案如下:

(1)写出沉淀A的化学式:___________________________________________________。
(2)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________________________。
(3)写出由沉淀A—→Al2O3的化学方程式:________________________,通入过量CO2生成沉淀A时反应的离子方程式为_______________________________________________。
Ⅱ、按照要求回答下列问题:
A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品)。
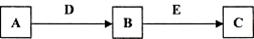
(1)若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质。
① 写出向B的溶液中加入足量D的离子反应方程式_____________________________________。
②向①所得的溶液中加入NaOH溶液,并在空气中放置的现象是:_________________________,写出固体在空气中放置的化学反应方程式:__________________________________________。

(1)写出沉淀A的化学式:___________________________________________________。
(2)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________________________。
(3)写出由沉淀A—→Al2O3的化学方程式:________________________,通入过量CO2生成沉淀A时反应的离子方程式为_______________________________________________。
Ⅱ、按照要求回答下列问题:
A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品)。

(1)若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质。
① 写出向B的溶液中加入足量D的离子反应方程式_____________________________________。
②向①所得的溶液中加入NaOH溶液,并在空气中放置的现象是:_________________________,写出固体在空气中放置的化学反应方程式:__________________________________________。
(1)Al(OH)3
(2)NaOH NaAlO2 NaCl
(3)2Al(OH)3 Al2O3+3H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
Al2O3+3H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
Ⅱ(1)①Fe+2Fe3+=3Fe2+
②生成白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
4Fe(OH)2+O2+2H2O = 4Fe(OH)3(没写 NaOH与 FeCl2反应不扣分)
(2)NaOH NaAlO2 NaCl
(3)2Al(OH)3
 Al2O3+3H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
Al2O3+3H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-Ⅱ(1)①Fe+2Fe3+=3Fe2+
②生成白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
4Fe(OH)2+O2+2H2O = 4Fe(OH)3(没写 NaOH与 FeCl2反应不扣分)
试题分析:Ⅰ(1)偏铝酸钠和过量的二氧化碳生成氢氧化铝和碳酸钠;
(2)前边有盐酸,这里因为氢氧化钠过量,所以有氢氧化钠、氯化钠、偏铝酸钠;
(3)氢氧化铝加热分解成氧化铝和水;
Ⅱ(1)①根据题意可知A为氯气,D为铁,铁能把三价铁离子还原为二价;
②氢氧化亚铁在空气中和氧气、水接触容易氧化为氢氧化铁。

练习册系列答案
相关题目


 操作正确且能达到目的的是
操作正确且能达到目的的是