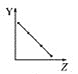题目内容
【题目】饱和氯水中存在平衡:Cl2+H2O![]() H++Cl-+HClO,下列说法错误的是( )
H++Cl-+HClO,下列说法错误的是( )
A.向该氯水中通入Cl2,平衡向右移动
B.向该氯水中通入少量SO2溶液的pH减小
C.向该氯水中加入CaCO3粉末,c(HClO)增大
D.升高温度,c(Cl2)减小
【答案】A
【解析】
A. 向该氯水中通入Cl2,由于已经达到饱和,平衡不移动,故A错误;
B. 向该氯水中通入少量SO2,发生Cl2+SO2+2H2O=2HCl+H2SO4,生成两种强酸,溶液的pH减小,故B正确;
C. 向该氯水中加入CaCO3粉末,与盐酸反应,平衡右移,c(HClO)增大,故C正确;
D. 升高温度,气体在水中溶解度变小,c(Cl2)减小,故D正确;
故选A。

【题目】“绿水青山就是金山银山”,因此如何消除大气污染物中的NOx、SO2等气体成为人们关注的主要问题之一。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1= a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2= b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3= c kJ/mol。
则反应2SO2(g)+ 4NH3·H2O(aq)+ O2(g) = 2(NH4)2SO4(aq)+ 2H2O(l)的ΔH=______kJ/mol。
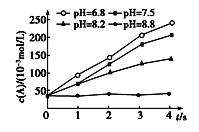
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~20 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入高效的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。
N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。
①已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
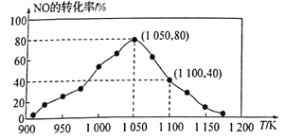
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为________________________________;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×105Pa时,该反应的化学平衡常数Kp=_____________________ [已知:气体分压(P分)=气体总压(P)×体积分数]。
(4)氮氧化物也可以用尿素[(NH2)2CO]水溶液吸收。用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为___________________________________。
(5)汽车尾气吸收还可利用反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正= k正·c2(NO)·c2(CO),v逆= k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正= k正·c2(NO)·c2(CO),v逆= k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的恒容密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为80%,则k正︰k逆=_____L/mol。
【题目】实验室探究制备高锰酸钾的绿色化方案,其实验流程如下:
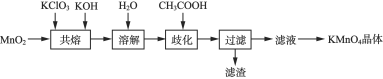
已知:![]() 水溶液呈墨绿色,在酸性、中性和弱碱性环境下,
水溶液呈墨绿色,在酸性、中性和弱碱性环境下,![]() 会发生自身氧化还原(歧化)反应,生成
会发生自身氧化还原(歧化)反应,生成![]() 和
和![]() ;部分试剂熔点、分解温度见下表:
;部分试剂熔点、分解温度见下表:
物质 |
|
|
|
|
|
熔点/ | 406 | 368 | —— | —— | —— |
分解温度/ | 1323 |
| 530 | 190 | 240 |
(1)在强碱性条件下,![]() 与
与![]() 共熔可制得
共熔可制得![]() ,其化学方程式为________。投料的顺序为先加入
,其化学方程式为________。投料的顺序为先加入![]() 和
和![]() 混合均匀,待小火完全熔融,再加入
混合均匀,待小火完全熔融,再加入![]() ,迅速搅拌。不能先将
,迅速搅拌。不能先将![]() 与
与![]() 混合的原因是________。
混合的原因是________。
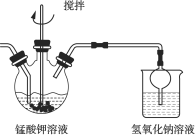
(2)溶解后所得溶液转入三颈瓶中,趁热滴入![]() 的乙酸,调节
的乙酸,调节![]() ,在如下图所示的装置中进行歧化。
,在如下图所示的装置中进行歧化。
①该步骤中如果pH控制过高,可能会导致________。
②判断三颈瓶中![]() 完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到________,表示
完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到________,表示![]() 已完全反应。
已完全反应。
(3)从提高原料利用率的角度分析,本实验流程的优点是________________。
(4)设计以滤液为原料,制取![]() 晶体的实验方案:________________(已知
晶体的实验方案:________________(已知![]() 在水溶液中,
在水溶液中,![]() 以上开始分解。实验中必须使用的设备:蒸发皿、恒温水浴槽、恒温干燥箱)。
以上开始分解。实验中必须使用的设备:蒸发皿、恒温水浴槽、恒温干燥箱)。