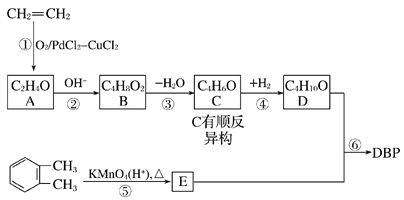
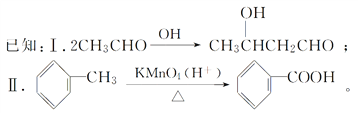
��Ŀ����
����Ŀ���ں���������ʵ���Һ�У������ж����ѧƽ��森
��1��һ���¶��£���1L 0.1molL��1CH3COOH��Һ�м���0.1mol CH3COONa���壬��Һ�� ![]() �����������С�����䡱����д����ʾ�û����Һ����������Ũ��֮���һ����ʽ ��
�����������С�����䡱����д����ʾ�û����Һ����������Ũ��֮���һ����ʽ ��
��2����������20mL 0.1molL��1Na2CO3��Һ����μ���0.1molL��1HCl��Һ40mL����Һ�к�̼Ԫ�صĸ�������CO2���ݳ�δ���������ʵ�����������ҺpH�仯��������£��ش��������⣺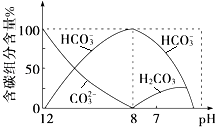
����ͬһ��Һ�У�H2CO3��HCO ![]() ��CO
��CO ![]() ����ܡ����ܡ����������棻
����ܡ����ܡ����������棻
�ڵ�pH=7ʱ����Һ�к�̼Ԫ�ص���Ҫ������ �� ��Һ�к������������������ʵ���Ũ�ȵĴ�С��ϵΪ ��
���𰸡�
��1�����䣻c��CH3COO����+c��OH����=c��Na+��+c��H+��
��2�����ܣ�HCO ![]() ��H2CO3��c��Na+����c��Cl������c��HCO
��H2CO3��c��Na+����c��Cl������c��HCO ![]() ��
��
���������⣺��1��һ���¶��£���1L 0.1molL��1CH3COOH��Һ�м���0.1mol CH3COONa���壬�����¶Ȳ��䣬��Ka= ![]() ֻ���¶��йأ�����
ֻ���¶��йأ����� ![]() �ı�ֵ���䣻��Һ�д��ڵ���غ�Ϊ��c��CH3COO����+c��OH����=c��Na+��+c��H+���� ���Դ��ǣ����䣻c��CH3COO����+c��OH����=c��Na+��+c��H+������2����������20mL0.1mol/L Na2CO3��Һ����μ���0.1mol/L HCl��Һ40mL���ȷ�Ӧ����̼�����ƣ��������ᷴӦ���ɶ�����̼��ˮ�����ɷ�Ӧ��ͼ���֪����ͬһ��Һ�У�H2CO3��HCO
�ı�ֵ���䣻��Һ�д��ڵ���غ�Ϊ��c��CH3COO����+c��OH����=c��Na+��+c��H+���� ���Դ��ǣ����䣻c��CH3COO����+c��OH����=c��Na+��+c��H+������2����������20mL0.1mol/L Na2CO3��Һ����μ���0.1mol/L HCl��Һ40mL���ȷ�Ӧ����̼�����ƣ��������ᷴӦ���ɶ�����̼��ˮ�����ɷ�Ӧ��ͼ���֪����ͬһ��Һ�У�H2CO3��HCO ![]() ��CO
��CO ![]() ���ܴ������棬���Դ��ǣ����ܣ�����ͼ���֪��pH=7ʱ����Һ�к�̼Ԫ�ص���Ҫ��ΪHCO
���ܴ������棬���Դ��ǣ����ܣ�����ͼ���֪��pH=7ʱ����Һ�к�̼Ԫ�ص���Ҫ��ΪHCO ![]() ��H2CO3 �� ����غ��֪c��Na+��+c��H+��=c��Cl����+c��HCO
��H2CO3 �� ����غ��֪c��Na+��+c��H+��=c��Cl����+c��HCO ![]() ��+c��OH��������c��Na+����c��Cl��������HCO3��ˮ�⣬����Һ�к������������������ʵ���Ũ�ȵĴ�С��ϵΪ��c��Na+����c��Cl������c��HCO
��+c��OH��������c��Na+����c��Cl��������HCO3��ˮ�⣬����Һ�к������������������ʵ���Ũ�ȵĴ�С��ϵΪ��c��Na+����c��Cl������c��HCO ![]() �������Դ��ǣ�HCO
�������Դ��ǣ�HCO ![]() ��H2CO3��c��Na+����c��Cl������c��HCO
��H2CO3��c��Na+����c��Cl������c��HCO ![]() ����
����
�����㾫�����������������ˮ��Һ�еĵ���ƽ�����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����

����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO��g��+2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H2
CH3OH��g��+H2O��g�� ��H2
��CO2��g��+H2��g��![]() CO��g��+H2O��g�� ��H3
CO��g��+H2O��g�� ��H3
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=______����֪��H2=��58 kJmol-1������H3=______��
��2���ϳ����е������Ƿ�չ�е�����Դ���������ð����Ʊ��������Ӧ���������ڡ���������ȣ�������Ϊȼ�ϵ��ŵ���__________________________________________________________��д�����㣩��ȱ����______________________________________________________________________��д�����㣩��
����Ŀ������ͼ��ʾװ�ý�������ʵ�飬����Һ©������ҺX����Բ����ƿ����Y��Ӧ�����Թ�B��������������ȷ����
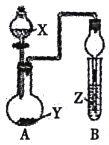
ѡ�� | X��Һ | ����Y | Z��Һ | ���� |
A | 70%H2SO4 | Na2SO3��Һ | H2S��Һ | �������� |
B | Ũ��ˮ | CaO | ��̪�Լ� | ��Һ��� |
C | ���� | ����ʯ | Na2SiO3��Һ | ���ְ�ɫ���� |
D | Ũ���� | MnO2 | NaOH��Һ | ����ɫ���屻���� |
A. A B. B C. C D. D