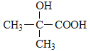题目内容
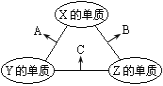
【题目】为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。
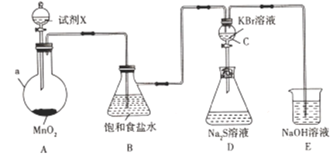
(1)仪器a的名称是______。试剂X是_____________。
(2)写出装置A中发生反应的化学方程式:__________________________________
(3)装置E中NaOH溶液的作用是____________________________________________
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:Cl___Br( 填“>"或"<")。
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。观察到的现象是______________,写出可能发生反应的离子方程式:_____________________________________写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是___________________________________________。
【答案】圆底烧瓶 浓盐酸 MnO2 +4HCl(浓)![]() MnCl2 +Cl2↑+2H2O 吸收多余氯气,防止污染环境 > 溶液变浑浊 Br2 +S2-=2Br- +S↓(或Cl2+S2-=2C1- +S↓) 溴水中可能含有氯气,干扰实验
MnCl2 +Cl2↑+2H2O 吸收多余氯气,防止污染环境 > 溶液变浑浊 Br2 +S2-=2Br- +S↓(或Cl2+S2-=2C1- +S↓) 溴水中可能含有氯气,干扰实验
【解析】
为了探究氯、溴、硫的非金属性强弱,装置A用于制备Cl2,装置C是验证Cl2的氧化性强于Br2 的氧化性,C装置生成的Br2 氧化D装置中的S2-,证明Br2 的氧化性强于S的。E装置是尾气吸收处理,防止污染环境。
(1)装置A用于制备Cl2,仪器a是圆底烧瓶,试剂X是浓盐酸;
(2)装置A中浓盐酸与二氧化锰反应制取氯气,反应的化学方程式为MnO2 +4HCl(浓)![]() MnCl2 +Cl2↑+2H2O ;
MnCl2 +Cl2↑+2H2O ;
(3)氯气是有毒气体,装置E是尾气处理装置,故装置E中NaOH溶液的作用是吸收多余氯气,防止污染环境;
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,是因为Cl2把装置C中的Br-氧化成Br2,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,说明非金属性:Cl>Br;
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。装置C中生成的Br2或者装置C中溶解了未反应完全的Cl2氧化装置D中的S2-,生成淡黄色的硫单质,可能发生反应的离子方程式为Br2 +S2-=2Br- +S↓(或Cl2+S2-=2C1- +S↓)。

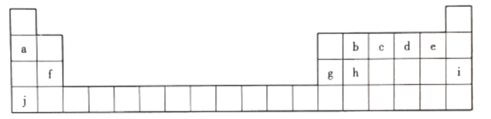
【题目】元素周期表中的四种元素的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
长周期元素 | Z | Z的一种盐乙可以做净水剂, |
W | W元素大量存在于海藻中,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为_____,X、Y、W三种元素的简单离子半径从大到小的顺序为_______。
(2)足量W的最高价氧化物的水化物的稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式_____。
(3)下列有关W的气态氢化物丁的说法正确的有_______(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性弱 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________。