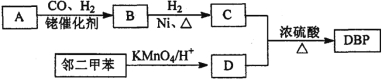
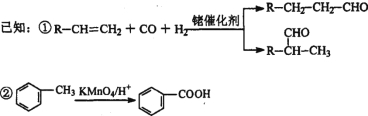
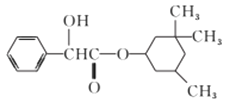
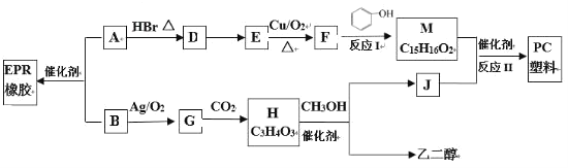
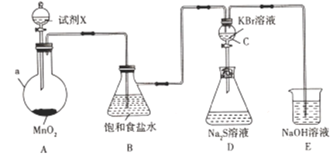
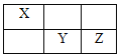
题目内容
【题目】元素周期表中的四种元素的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
长周期元素 | Z | Z的一种盐乙可以做净水剂, |
W | W元素大量存在于海藻中,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为_____,X、Y、W三种元素的简单离子半径从大到小的顺序为_______。
(2)足量W的最高价氧化物的水化物的稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式_____。
(3)下列有关W的气态氢化物丁的说法正确的有_______(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性弱 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________。
【答案】第三周期ⅢA族 r(I—)>r(N3—)>r(Al3+) HIO4(aq)+![]() Al(OH)3(s)=H2O(l)+
Al(OH)3(s)=H2O(l)+![]() Al(IO4)3(aq)△H=-
Al(IO4)3(aq)△H=-![]() QkJ/mol a Fe2O3+6H++2I—=2Fe2++I2+3H2O
QkJ/mol a Fe2O3+6H++2I—=2Fe2++I2+3H2O
【解析】
X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液,则甲为氢氧化铝,X为Al元素;Y的一种氢化物可用于制造纯碱和做制冷剂,则该氢化物为氨气,Y为N元素;Z的一种盐乙可以做净水剂,![]() 的某种氧化物丙可以做红色涂料,则丙为氧化铁,乙为铁盐,Z为Fe元素;W元素大量存在于海藻中,它的银盐可用于人工降雨,则W为I元素,在结合元素周期律与物质的性质分析答题。
的某种氧化物丙可以做红色涂料,则丙为氧化铁,乙为铁盐,Z为Fe元素;W元素大量存在于海藻中,它的银盐可用于人工降雨,则W为I元素,在结合元素周期律与物质的性质分析答题。
根据上述分析可知:X为Al元素,Y为N元素,Z为Fe元素,W为I元素,
(1)X为Al元素,原子序数为13,在周期表中的位置为第三周期第ⅢA族;原子的电子层数越大,其原子半径越大,电子层数相同时,其离子半径随着原子序数的增大而减小,则X、Y、W三种元素的简单离子半径从大到小的顺序为:r(I—)>r(N3—)>r(Al3+),故答案为:r(I—)>r(N3—)>r(Al3+)。
(2)W的最高价氧化物的水化物为HIO4与1mol氢氧化铝完全反应,放出热量QkJ,则反应生成1mol水所放出的热量为![]() QkJ,则表示该过程中和热的热化学方程式为:HIO4(aq)+
QkJ,则表示该过程中和热的热化学方程式为:HIO4(aq)+![]() Al(OH)3(s)=H2O(l)+
Al(OH)3(s)=H2O(l)+![]() Al(IO4)3(aq) △H=-
Al(IO4)3(aq) △H=-![]() QkJ/mol,故答案为:HIO4(aq)+
QkJ/mol,故答案为:HIO4(aq)+![]() Al(OH)3(s)=H2O(l)+
Al(OH)3(s)=H2O(l)+![]() Al(IO4)3(aq) △H=-
Al(IO4)3(aq) △H=-![]() QkJ/mol。
QkJ/mol。
(3)W的气态氢化物丁为HI,则
a.HCl与HI均为共价化合物,其分子间作用力越大,沸点越高,则分子间作用力大小:HI>HCl,则沸点高低:HI>HCl,故a正确;
b.非金属性越强,对应气态氢化物的稳定性越高,则碘化氢比氯化氢稳定性低,故b错误;
c.同主族元素中非金属性从上而下依次减弱,单质的氧化性依次减弱,则相应离子的还原性依次增强,则碘化氢比氟化氢还原性强,故c错误;
d.氟化氢为弱酸,碘化氢为强酸,则碘化氢比氟化氢酸性强,故d错误。
故答案为:a。
(4)丙为氧化铁,丁为HI,两者会发生氧化还原反应,其离子方程式为:Fe2O3+6H++2I—=2Fe2++I2+3H2O,故答案为:

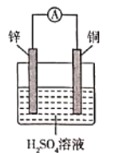
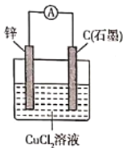
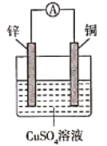
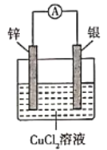
【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |
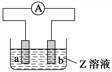
A. A B. B C. C D. D