题目内容
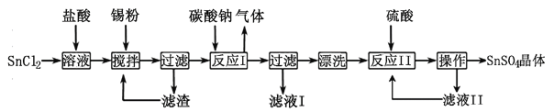
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
III.Sn(OH)2的性质与Al(OH)3性质相似。请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是。
(2)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子方程式是。
(3)将反应I滤液中的溶质提取出来的操作是,滤液I溶质的成分是。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是。
(5)称取SnSO4·xH2O晶体50.2g,在隔绝空气的情况下小火加热至结晶水全部失去,冷却称量固体质量为43g,则该晶体的化学式为。
【答案】(1)抑制SnCl2水解(2)Sn2++CO32-═SnO↓+CO2↑
(3)蒸发结晶,NaCl、Na2CO3
(4)Sn2++H2O2+2H+═Sn4++2H2O
(5)SnSO4·2H2O
【解析】试题分析:(1)SnCl2粉末需加浓盐酸进行溶解,是因为SnCl2是强酸弱碱盐,在水中容易发生水解反应SnCl2+H2O![]() Sn(OH)Cl+HCl。若用盐酸来溶解,由于增大了生成物的浓度,可以使水解平衡向逆反应方向移动,来减少SnCl2的水解反应的发生。(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价未变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-=SnO↓+CO2↑;(3)根据原子守恒可知溶液中的溶质还有氯化钠及剩余的碳酸钠,所以将反应I滤液中的溶质提取出来的操作是蒸发浓缩、冷却结晶。(4)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+=Sn4++2H2O;(5)称取SnSO4·xH2O晶体50.2g,在隔绝空气的情况下小火加热至结晶水全部失去,冷却称量固体质量为43g,则结晶水的质量50.2g-43g=7.2g,则
Sn(OH)Cl+HCl。若用盐酸来溶解,由于增大了生成物的浓度,可以使水解平衡向逆反应方向移动,来减少SnCl2的水解反应的发生。(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价未变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-=SnO↓+CO2↑;(3)根据原子守恒可知溶液中的溶质还有氯化钠及剩余的碳酸钠,所以将反应I滤液中的溶质提取出来的操作是蒸发浓缩、冷却结晶。(4)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+=Sn4++2H2O;(5)称取SnSO4·xH2O晶体50.2g,在隔绝空气的情况下小火加热至结晶水全部失去,冷却称量固体质量为43g,则结晶水的质量50.2g-43g=7.2g,则![]() ,解得x=2,因此该晶体的化学式为SnSO4·2H2O。
,解得x=2,因此该晶体的化学式为SnSO4·2H2O。

 阳光课堂课时优化作业系列答案
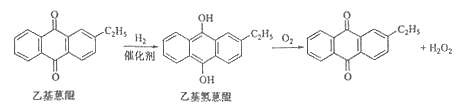
阳光课堂课时优化作业系列答案【题目】化学——选修2:化学与技术]双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
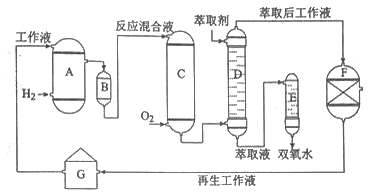
A.氢化釜 |
B.过滤器 |
C.氧化塔 |
D.萃取塔 |
E.净化塔
F.工作液再生装置
G.工作液配制装置 生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是 ,循环使用的原料是 ,配制工作液时采用有机溶剂而不采用水的原因是 。
(2)氢化釜A中反应的化学方程式为 ,进入氧化塔C的反应混合液中的主要溶质为 。
(3)萃取塔D中的萃取剂是,选择其作萃取剂的原因是 。
(4)工作液再生装置F中要除净残留的H2O2,原因是 。
(5)双氧水浓度可在酸性条件下用 KMnO4溶液测定,该反应的离子方程式为___________一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为 mol/L。


