题目内容
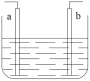
【题目】密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为

A.1:2
B.3:2
C.5:2
D.7:2
【答案】D
【解析】
试题分析:反应前左右压强都相等,气体的物质的量之比等于体积之比,令空气的物质的量为1mol,则氢气、氧气的混合气体为3mol.反应后恢复至原来的温度,活塞正好停留在容器的中间。说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,若剩余的气体为氢气,参加反应气体共2mol,由2H2+O2![]() 2H2O可知,氧气为2mol×
2H2O可知,氧气为2mol×![]() =
=![]() mol,故氢气为3mol-
mol,故氢气为3mol-![]() mol=
mol=![]() mol,故H2、O2的体积比为
mol,故H2、O2的体积比为![]() mol:
mol:![]() mol=7:2;若剩余的气体为氧气,参加反应气体共2mol,由2H2+O2
mol=7:2;若剩余的气体为氧气,参加反应气体共2mol,由2H2+O2![]() 2H2O可知,氢气为2mol×
2H2O可知,氢气为2mol×![]() =
=![]() mol,故氧气为3mol-
mol,故氧气为3mol-![]() mol=
mol=![]() mol,故H2、O2的体积比为
mol,故H2、O2的体积比为![]() mol:
mol:![]() mol=4:5,答案选D。
mol=4:5,答案选D。

练习册系列答案
相关题目