题目内容
7.下列有关化学用语表述错误的是( )| A. |  的系统命名:2-丙醇 的系统命名:2-丙醇 | B. | 明矾的化学式:KAl(SO4)2•12H2O | ||
| C. | CH4Si的结构式: | D. | H2O2的球棍模型: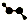 |
分析 A、醇类的命名选取含有羟基的最长碳链,据此羟基最近的一端命名为1号碳;
B、明矾为十二水和硫酸铝钾,依据化合价代数和为0,书写即可;
C、C与Si在化合物中均能形成4个共价键,据此判断即可;
D、过氧化氢含有2个O和2个H原子,据此解答即可.
解答 解:A、 含有羟基的最长碳链为3,羟基在2号碳上,正确命名为:2-丙醇,故A正确;
含有羟基的最长碳链为3,羟基在2号碳上,正确命名为:2-丙醇,故A正确;
B、明矾为十二水和硫酸铝钾,Al在化合物中的化合价为+3,K为+1,硫酸根为-2价,故正确化学式为:KAl(SO4)2•12H2O,故B正确;
C、 此结构式中C与Si均剩余1个单电子,故错误,正确应为:
此结构式中C与Si均剩余1个单电子,故错误,正确应为: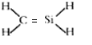 ,故C错误;
,故C错误;
D、过氧化氢中含有2个O原子和2个H原子,O原子采取sp2杂化,故其模型为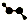 ,故D正确,故选C.
,故D正确,故选C.
点评 本题主要考查的是常见化学用语,即有机物的命名、化学式书写、C的成键特点、双氧水的结构模型等,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列叙述正确的是( )
| A. | 光导纤维中所用材料为晶体硅 | |
| B. | SiO2是酸性氧化物,所以不与任何酸反应 | |
| C. | 可用Na2SiO3溶液和CO2反应来制备H2SiO3 | |
| D. | NaOH溶液可以盛装在带玻璃塞的磨口试剂瓶中 |
2.在一定温度下,向aL恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g).此反应达到平衡的标志是( )
| A. | 容器内X、Y、Z的速率之比为1:2:2 | |
| B. | 单位时间生成0.1 mol X的同时生成0.2 mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | 容器内气体密度不随时间变化 |
12.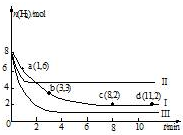 一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
CO2(g)+3H2?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线I所示.下列说法正确的是( )
 一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:CO2(g)+3H2?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线I所示.下列说法正确的是( )
| A. | 该反应在0~8min内CO2的平均反应速率是0.375mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的条件分数大于20% | |
| C. | 若起始是向上述容器中充入4molCO2、2molH2、2molCH3OH和1molH2O(g),则此是反应向正反应方向进行 | |
| D. | 改变条件得到曲线II、III,则曲线II、III改变的他分别是升高温度、充入氢气 |
19.有一种常见的有机抗冻剂,1mol该有机物与足量金属钠反应,生成的气体在标准状况下的体积为22.4L.该有机物可能是( )
| A. | 甲醇 | B. | 乙醇 | C. | 乙二醇 | D. | 丙三醇 |
 .实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.
.实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气. 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.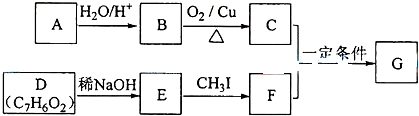
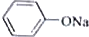 +RCH2I→
+RCH2I→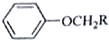
 .
.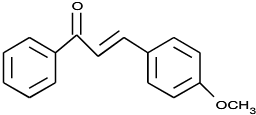 .
.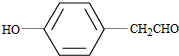 (写结构简式).
(写结构简式).